题目内容
2.某两种金属粉末的混合物2.0g,投入足量的稀盐酸中,产生的氢气在标准状态下体积为1.12升,则该混合物可能是( )| A. | Mg、Na | B. | Al、Mg | C. | Fe、Cu | D. | Fe、Zn |
分析 标准状况下1.12L氢气的物质的量为:$\frac{1.12L}{22.4L/mol}$=0.05mol,根据电子转移守恒,2.0g金属提供电子为0.05mol×2=0.1mol,故提供1mol电子需要金属的平均质量为:2.0g×$\frac{1mol}{0.1mol}$=20g,结合化合价计算提供1mol电子需要金属的质量,结合平均值判断.
解答 解:标准状况下1.12L氢气的物质的量为:$\frac{1.12L}{22.4L/mol}$=0.05mol,根据电子转移守恒,2.0g金属提供电子为0.05mol×2=0.1mol,故提供1mol电子需要金属的平均质量为:2.0g×$\frac{1mol}{0.1mol}$=20g,
A.反应中Na为+1价,提供1mol电子需要Na的质量为:1mol×23g/mol=23g,反应中Mg为+2价,提供1mol电子需要Mg的质量=1mol×24g/mol×$\frac{1}{2}$=12g,二者混合提供1mol电子质量可能为20,故A正确;
B.反应中Mg为+2价,提供1mol电子需要Mg的质量为:$\frac{1mol}{2}$×24g/mol=12g,反应中Al为+3价,提供1mol电子需要Al的质量为:$\frac{1mol}{3}$×27g/mol=9g,二者混合提供1mol电子质量不可能为20,故B错误;
C.反应中Fe为+2价,提供1mol电子需要Fe的质量为:$\frac{1mol}{2}$×56g/mol=28g,Cu不与稀盐酸反应,则二者提供1mol电子的质量不可能为20g,故C错误;
D.Zn为+2价金属,提供1mol电子需要Zn的质量为:$\frac{1mol}{2}$×65g/mol=32.5,反应中Fe为+2价,提供1mol电子需要Fe的质量为:$\frac{1mol}{2}$×56g/mol=28g,二者混合提供1mol电子质量不可能为20,故D错误;
故选A.
点评 本题考查了混合物反应的计算,题目难度中等,注意掌握平均值法在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.

| A. | H2S、H2O、HF 的稳定性依次增强 | |
| B. | RbOH、KOH、Ca(OH)2的碱性依次减弱 | |
| C. | Na、Mg、Al 的还原性依次增强 | |
| D. | H4SiO4、H2CO3、H2SO4的酸性依次增强 |
| A. | 明矾溶液加热 | B. | CH3COONa溶液加热 | ||
| C. | 氨水中加入少量NH4Cl | D. | Na2CO3溶液中加入BaCl2固体 |
| A. | 氧气 | B. | 氮气 | C. | C2H4 | D. | NO |
| A. | NaOH | B. | H2S | C. | Ba(OH)2 | D. | AgNO3 |
| X | Y | ||
| Z | W |
| A. | Y元素最高价氧化物对应的水化物化学式为H3YO4 | |
| B. | 原子半径由小到大的顺序为:X<Z<Y<W | |
| C. | 与同浓度的盐酸反应,Z比W更剧烈 | |
| D. | X的氧化物是碱性氧化物 |
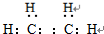 ,B的结构简式
,B的结构简式 或
或 .
.