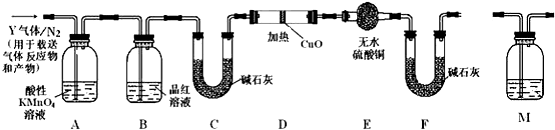
题目内容
8.(1)6.0g石墨与适量的水蒸气反应生成二氧化碳气体和氢气,吸收56.7kJ 热量.其热化学方程式为C(s 石墨)+H2O(g)=CO(g)+H2(g)△H=+113.4kJ/mol.(2)3molNO2气体溶于水生成HNO3和NO气体,放出138kJ热量其热化学方程式为3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)△H=-138kJ/mol.
(3)甲硅烷(SiH4)是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和水,常温下1g甲硅烷自燃放出的热量为44.6KJ,其热化学方程式为SiH4(g)+2O2(g)=SiO2(s)+2H2O(l)△H=-1427.2kJ/mol.
分析 热化学方程式的书写:标明物质的聚集状态;焓变符号中的“+”和“-”代表吸热和放热,化学反应的焓变和物质的量相对应.
解答 解:(1)发生反应C+H2O=CO+H2,1mol石墨反应吸收的热量为56.7kJ×$\frac{1mol×12g/mol}{6g}$=113.4kJ,故该反应热化学方程式为:C(s 石墨)+H2O(g)=CO(g)+H2(g)△H=+113.4kJ/mol,
故答案为:C(s 石墨)+H2O(g)=CO(g)+H2(g)△H=+113.4kJ/mol;
(2)3molNO2气体溶于水生成HNO3和NO气体,放出138kJ热量,其热化学方程式为:3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)△H=-138kJ/mol,
故答案为:3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)△H=-138kJ/mol;
(3)甲硅烷(SiH4)是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和水,常温下1g甲硅烷自燃放出的热量为44.6KJ,则1mol SiH4反应放出的热量为44.6kJ×32=1427.2kJ,其热化学方程式为SiH4(g)+2O2(g)=SiO2(s)+2H2O(l)△H=-1427.2kJ/mol,
故答案为:SiH4(g)+2O2(g)=SiO2(s)+2H2O(l)△H=-1427.2kJ/mol.
点评 本题考查热化学方程式书写与判断,比较基础,注意掌握热化学方程书写规则.

练习册系列答案
相关题目
16.已知下列反应,在其变化时,必须加入氧化剂才能实现的是( )
| A. | CaCO3→CO2 | B. | Cl2→HClO | C. | Na→Na+ | D. | Al3+→Al |
3.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 23 g Na与足量H2O反应完全后可生成NA个H2分子 | |
| B. | 1 mol Na2O2和足量CO2反应转移2 NA个电子 | |
| C. | 标准状况下,22.4 L N2和H2混合气中含NA个原子 | |
| D. | 3 mol单质Fe完全转变为Fe3O4,失去8 NA个电子 |
18.辉铜矿(主要成分为Cu2S)经火法冶炼,可制得Cu和H2SO4,流程如下图所示:
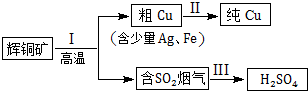
(1)Cu2S(硫化亚铜)中Cu元素的化合价是+1价.
(2)冶炼过程中产生的SO2气体如果直接排放到空气中,会形成酸雨,请写出SO2在空气中转化形成硫酸型酸雨的反应方程式2SO2+O2?2SO3、SO3+H2O═H2SO4,或SO2+H2O?H2SO3,2H2SO3+O2═2H2SO4.
(3)过程I中产生的烟气除了含有SO2气体,还含有少量CO2气体.
①检验烟气中的CO2气体需先将SO2气体除去.为保证CO2气体的检验,除去SO2气体可选用的试剂是B(填序号).
A.NaOH溶液B.KMnO4酸性溶液
②将过程I产生的烟气通入一定量的NaOH溶液中,得到的溶液显中性,其中包括的离子及浓度如下所示(其他离子忽略不计):
则c(Na+)=0.325mol/L.

(1)Cu2S(硫化亚铜)中Cu元素的化合价是+1价.
(2)冶炼过程中产生的SO2气体如果直接排放到空气中,会形成酸雨,请写出SO2在空气中转化形成硫酸型酸雨的反应方程式2SO2+O2?2SO3、SO3+H2O═H2SO4,或SO2+H2O?H2SO3,2H2SO3+O2═2H2SO4.
(3)过程I中产生的烟气除了含有SO2气体,还含有少量CO2气体.
①检验烟气中的CO2气体需先将SO2气体除去.为保证CO2气体的检验,除去SO2气体可选用的试剂是B(填序号).
A.NaOH溶液B.KMnO4酸性溶液
②将过程I产生的烟气通入一定量的NaOH溶液中,得到的溶液显中性,其中包括的离子及浓度如下所示(其他离子忽略不计):
| 所含离子 | Na+ | HCO3- | CO32- | SO32- | HSO3- |
| 浓度mol/L | 0.005 | 0.01 | 0.05 | 0.2 |

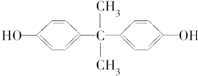 ).聚碳酸酯不耐高温,100℃时释放出的双酚A是25℃时的50倍.双酚A进入人体后,会溶解在身体的血管里,导致致命性的血管疾病.请回答下列问题:
).聚碳酸酯不耐高温,100℃时释放出的双酚A是25℃时的50倍.双酚A进入人体后,会溶解在身体的血管里,导致致命性的血管疾病.请回答下列问题: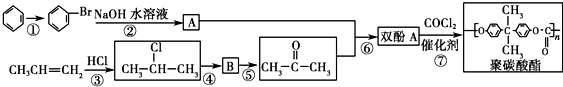
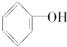 .
.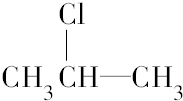 按系统命名法的名称为2-氯丙烷.
按系统命名法的名称为2-氯丙烷.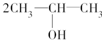 +O2$→_{△}^{催化剂}$
+O2$→_{△}^{催化剂}$ +2H2O.
+2H2O.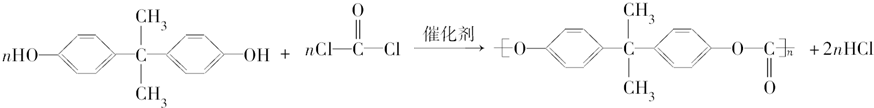 ,
,