题目内容
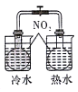
2.碳及其化合物广泛存在于自然界中,试回答下列问题:(1)某处碳循环如图1所示,CaCO3转化为HCO3-的离子方程式为CO2+CaCO3+H2O=Ca2++2HCO3-.
(2)常温常压下,空气中的CO2溶于水,达到平衡时,无机碳在浓液中以4种形式存在,其转化关系如下:
①CO2(g)+H2O?H2CO3 K=10-2.8
②H2CO3?H++HCO3- K1=10-3.5,
③HCO3-?H++CO32- K2=10-10.3,
若溶液中.c(CO2)=1.0×10-5mol/L,且忽略水的电离及H2CO3的第二级电离,则溶液pH=5.65.
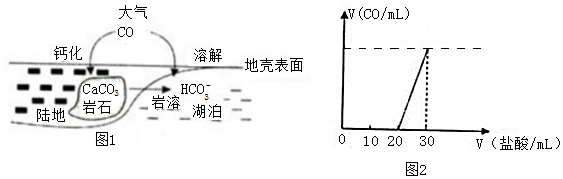
(3)某化学小组为了测量湖水中无机碳的含量,量取 100mL湖水,酸化后用N2吹出CO2,再用NaOH溶液吸收,将吸收液用0.10mol/L盐酸滴定,生成的V(CO2)随V (盐酸)变化关系如图2所示,则吸收液中离子浓度由大到小的顺序为c(Na+)>c(OH-)>c(CO32-)>c(HCO3-)(不用写出H+),湖水中无机碳的浓度为0.01mol/L.
(4)一定条件下,CO2和H2O可以转化为CO和H2,通过反应:CO(g)+2H2(g)?CH3OH(g)制备甲醇,若起始时在密闭容器中按物质的量之比1:2充入CO和H2,测得平衡时CO转化率a (CO)随T、P的变化关系如图4所示.
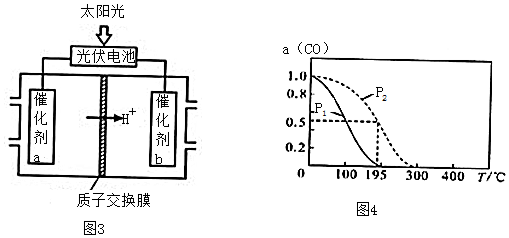
①P1小于P2(填“大于”、“小于”或“等于”);
②该反应在195℃、P2条件下达到平衡后,c(H2)=0.5mol/L,则该反应的平衡常数为4.
③已知CH3OH和CO的燃烧热分别725.8kJ/mol、283.0kJ/mol,1mol液态水变成气态水吸热44.0kJ,写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式:CH3OH(l)+O2(g)=CO(g)+2H2O(g)△H=-354.8kJ∕mol.
(5)用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图3,则a电极的反应方程式为:CH3OH-6e-+H2O=CO2+6H+.
分析 (1)碳酸钙、二氧化碳和水反应生成可溶性的碳酸氢钙;
(2)方程式①+②得CO2(g)+H2O?H++HCO3- K=10-2.8×10-3.5=10-6.3,
c(H+)=$\sqrt{K.c(C{O}_{2})}$,则溶液的pH=-lg$\sqrt{K.c(C{O}_{2})}$;
(3)碳酸钠和盐酸反应方程式为Na2CO3+HCl=NaHCO3+NaCl、NaHCO3+HCl=NaCl+CO2↑+H2O,如果吸收液中完全是碳酸钠,第一步、第二步反应消耗的酸体积应该相同,实际上没有生成二氧化碳消耗的HCl是生成二氧化碳消耗盐酸的2倍,说明溶液中还含有NaOH,且c(NaOH)=c(Na2CO3),溶液呈碱性,且碳酸根离子部分水解;
根据原子守恒计算C含量;
(4)①相同温度下,增大压强平衡正向移动,CO转化率增大;
②该反应在195℃、P2条件下,加入的氢气和CO物质的量之比等于该反应中其计量数之比,所以CO和氢气的转化率相同都是50%,平衡时c(H2)=0.5mol/L,则c(CO)=0.25mol/L,参加反应的c(CO)=0.25mol/L,生成的c(CH3OH)=0.25mol/L,化学平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO).{c}^{2}({H}_{2})}$;
③由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-725.8kJ•mol-1,水的摩尔蒸发焓为44.0 kJ/mol,则
①CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ•mol-1
②CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2 H2O(l)△H=-725.8kJ•mol-1
③H2O(l)=H2O(g)△H=-44KJ/mol
由盖斯定律可知用②-①+③×2得到热化学方程式;
(5)该燃料电池中,根据氢离子移动方向知,a是负极、b是正极,负极上甲醇失电子生成二氧化碳和氢离子.
解答 解:(1)碳酸钙、二氧化碳和水反应生成可溶性的碳酸氢钙,离子方程式为CO2+CaCO3+H2O=Ca2++2HCO3-,
故答案为:CO2+CaCO3+H2O=Ca2++2HCO3-;
(2)方程式①+②得CO2(g)+H2O?H++HCO3- K=10-2.8×10-3.5=10-6.3,
c(H+)=$\sqrt{K.c(C{O}_{2})}$,则溶液的pH=-lg$\sqrt{K.c(C{O}_{2})}$=-lg$\sqrt{1{0}^{-6.3}×1.0×1{0}^{-5}}$=5.65,
故答案为:5.65;
(3)碳酸钠和盐酸反应方程式为Na2CO3+HCl=NaHCO3+NaCl、NaHCO3+HCl=NaCl+CO2↑+H2O,如果吸收液中完全是碳酸钠,第一步、第二步反应消耗的酸体积应该相同,实际上没有生成二氧化碳消耗的HCl是生成二氧化碳消耗盐酸的2倍,说明溶液中还含有NaOH,且c(NaOH)=c(Na2CO3),溶液呈碱性,且碳酸根离子部分水解,所以溶液中离子浓度大小顺序是c(Na+)>c(OH-)>c(CO32-)>c(HCO3-);
和碳酸氢钠反应消耗的HCl体积是10mL,则n(HCl)=0.10mol/L×0.010L=0.001mol,根据方程式NaHCO3+HCl=NaCl+CO2↑+H2O得n(HCl)=n(NaHCO3)=0.001mol,根据碳原子守恒得n(C)=n(NaHCO3)=0.001mol,所以湖水中无机碳的浓度为=$\frac{0.001mol}{0.1L}$=0.01mol/L,
故答案为:c(Na+)>c(OH-)>c(CO32-)>c(HCO3-);0.01;
(4)①相同温度下,增大压强平衡正向移动,CO转化率增大,根据图知,相同温度下P1条件下的CO转化率小于P2,则P1小于P2,故答案为:小于;
②该反应在195℃、P2条件下,加入的氢气和CO物质的量之比等于该反应中其计量数之比,所以CO和氢气的转化率相同都是50%,平衡时c(H2)=0.5mol/L,则c(CO)=0.25mol/L,参加反应的c(CO)=0.25mol/L,生成的c(CH3OH)=0.25mol/L,化学平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO).{c}^{2}({H}_{2})}$=$\frac{0.25}{0.25×0.{5}^{2}}$=4,
故答案为:4;
③由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-725.8kJ•mol-1,则
①CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ•mol-1
②CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2 H2O(l)△H=-725.8kJ•mol-1
③H2O(l)=H2O(g)△H=-44KJ/mol
由盖斯定律可知用②-①+③×2得反应CH3OH(l)+O2(g)=CO(g)+2 H2O(g),该反应的反应热△H=-725.8kJ•mol-1-(-283.0kJ•mol-1)+2×44KJ/mol=-354.8kJ•mol-1,
故答案为:CH3OH (l)+O2(g)=CO (g)+2H2O (g)△H=-354.8 kJ∕mol;
(5)该燃料电池中,根据氢离子移动方向知,a是负极、b是正极,负极上甲醇失电子生成二氧化碳和氢离子,电极反应式为CH3OH-6e-+H2O=CO2+6H+,故答案为:CH3OH-6e-+H2O=CO2+6H+.
点评 本题考查较综合,涉及化学平衡计算、盖斯定律、离子浓度大小比较、电化学等知识点,侧重考查学生理解、分析及计算能力,明确化学反应原理是解本题关键,注意(4)题中如果“加入的气体反应物物质的量之比等于其计量数之比,则其转化率相等”,题目难度不大.

 全能练考卷系列答案
全能练考卷系列答案| A. | pH=2的CH3COOH 溶液与pH=12的Na0H溶液等体积混合:c(Na+)=c(CH3COO-)>c(CH3COOH) | |
| B. | 盐酸与FeCl3的混合溶液pH=2,稀释10倍后:pH<3 | |
| C. | pH相同的①NH4HSO4、②NH4Cl、③(NH4)2SO4三种溶液的c(NH4+):③>①>② | |
| D. | pH=3的H2C2O4溶液:c(H+)=c(HC2O4-)+c(OH-)=1×10-3mol/L |
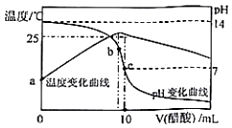 在某温度时,将nmol/L醋酸溶液滴入10mL1.0mol/LNaOH溶液中,溶液pH和温度随加入醋酸溶液体积变化曲线如图所示,下列有关说法正确的是( )
在某温度时,将nmol/L醋酸溶液滴入10mL1.0mol/LNaOH溶液中,溶液pH和温度随加入醋酸溶液体积变化曲线如图所示,下列有关说法正确的是( )| A. | n>1.0 | B. | a点Kw=1.0×10-14 | ||
| C. | 水的电离程度:c>b | D. | b点:c(CH3COO-)>c(Na+)>c(OH-)>c(H+) |
| A. | 12 g石墨和C60的混合物中质子总数为6NA | |
| B. | 1 L pH=1的硫酸溶液中含有的H+数为0.2NA | |
| C. | 由1 mol NH4Cl和少量氨水形成的中性溶液中,NH4+数目小于NA个 | |
| D. | 在标准状况下,2.24L的C12溶于水,充分反应后转移电子数一定为0.1NA |
| A. | 酸性:H2SO4>H2CO3 | B. | 沸点:CBr4>CCl4 | ||
| C. | 碱性:Al(OH)3>NaOH | D. | 热稳定性:HF>HCl |
| A. | NH4Cl | B. | Cu2S | C. | FeCl2 | D. | Al(OH)3 |
| A. | 滤液为NaCl饱和溶液 | B. | 滤液中NaCl的质量分数为36% | ||
| C. | 该温度下,NaCl的溶解度为50g | D. | 该温度下,NaCl的溶解度为36g |