题目内容
17.某实验室仅有如下仪器或用具:烧杯、铁架台、铁圈、三脚架、普通漏斗、石棉网、酒精灯、玻璃棒、量筒、蒸发皿、圆底烧瓶、滤纸、火柴.从缺乏仪器或用具的角度看,不能进行的实验操作项目是( )| A. | 过滤 | B. | 蒸发 | C. | 萃取 | D. | 溶解 |
分析 A.过滤要用到的仪器有:烧杯、漏斗、玻璃棒、铁架台、铁圈、滤纸;
B.蒸发要用到的仪器有:酒精灯、蒸发皿、玻璃棒、铁架台、铁圈、火柴;
C.萃取需要的仪器有:分液漏斗和烧杯;
D.溶解用到的仪器有:烧杯、玻璃棒.
解答 解:A.过滤要用到的仪器有:烧杯、漏斗、玻璃棒、铁架台、铁圈、滤纸,因此可以进行过滤操作,故A不选;
B.蒸发要用到的仪器有:酒精灯、蒸发皿、玻璃棒、铁架台、铁圈,因此可以进行蒸发操作,故B不选;
C.萃取需要的仪器有:分液漏斗和烧杯,缺少分液漏斗,因此不能进行萃取操作,故C选;
D.溶解用到的仪器有:烧杯、玻璃棒,因此可以进行溶解操作,故D不选;
故选C.
点评 本题考查物质分离、提纯的方法及常见实验仪器,侧重于学生的分析能力和实验能力的考查,难度不大,注意熟悉常见实验及其所用仪器和各种仪器的作用.

练习册系列答案
相关题目
17.某化学探究小组拟用废铜屑制取Cu(NO3)2,并探究其化学性质.
I.如图1,用浓HNO3,和过量的废铜屑充分反应制硝酸铜溶液.
(1)写出铜与浓硝酸反应的离子方程式Cu+4H++2NO3-=Cu2++2NO2↑+2H2O.
(2)①装置中NaOH溶液的作用是吸收氮氧化物,防止污染空气.
②欲从反应后的溶液中得到硝酸铜晶体,实验操作步骤是蒸发浓缩、冷却结晶、过滤.
③你认为此装置是否合理,并说明原因不合理,密闭体系中立即产生大量气体,会有安全隐患;或者合理,慢慢挤压,胶头滴管控制反应速率,使NaOH溶液及时吸收NO2.
如果不合理,同时在原装置上改进;如果合理,只需说明原因.
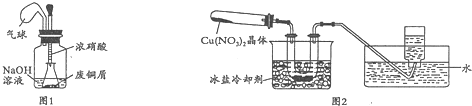
Ⅱ.为了探究Cu(NO3)2的热稳定性,探究小组按图2装置进行实验.(图中铁架台、铁夹和加热仪器均略去)
【实验装置】
【实验操作及现象】往试管中放入研细的无水Cu(NO3)2晶体并加热,观察到试管中有红棕色气体生成,最终残留黑色粉末;用U型管除去红棕色气体,在集气瓶中收集到无色气体.
【解释与结论】
(3)①红棕色气体是NO2.
②根据现象判断Cu(NO3)2在加热条件下可以分解,其化学反应方程式为2Cu(NO3)2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+4NO2↑+O2↑.
Ⅲ.利用Cu(NO3)2制备浅绿色的碱式碳酸铜[CuCO3•Cu(OH)2].
向大试管中加入一定量的碳酸钠溶液和硝酸铜溶液,水浴加热,用0.4mol•L-1的NaOH溶液调节pH至8.5,振荡、静置、过滤、洗涤、干燥,得到样品.
【实验数据】反应温度对样品的影响
(4)滤液中可能含有CO32-,写出检验CO32-的方法取少量滤液置于试管中,加入足量稀盐酸,将产生的气体通入澄清石灰水,溶液变浑浊,说明含碳酸根离子.
(5)95℃时,样品颜色发暗的原因:含有黑色的氧化铜.
(6)70℃时,实验得到2.38g样品,取此样品加热至分解完全(杂质不分解),得到1.76g固体,此样品中碱式碳酸铜的质量分数是93.3%.
I.如图1,用浓HNO3,和过量的废铜屑充分反应制硝酸铜溶液.
(1)写出铜与浓硝酸反应的离子方程式Cu+4H++2NO3-=Cu2++2NO2↑+2H2O.
(2)①装置中NaOH溶液的作用是吸收氮氧化物,防止污染空气.
②欲从反应后的溶液中得到硝酸铜晶体,实验操作步骤是蒸发浓缩、冷却结晶、过滤.
③你认为此装置是否合理,并说明原因不合理,密闭体系中立即产生大量气体,会有安全隐患;或者合理,慢慢挤压,胶头滴管控制反应速率,使NaOH溶液及时吸收NO2.
如果不合理,同时在原装置上改进;如果合理,只需说明原因.

Ⅱ.为了探究Cu(NO3)2的热稳定性,探究小组按图2装置进行实验.(图中铁架台、铁夹和加热仪器均略去)
【实验装置】
【实验操作及现象】往试管中放入研细的无水Cu(NO3)2晶体并加热,观察到试管中有红棕色气体生成,最终残留黑色粉末;用U型管除去红棕色气体,在集气瓶中收集到无色气体.
【解释与结论】
(3)①红棕色气体是NO2.
②根据现象判断Cu(NO3)2在加热条件下可以分解,其化学反应方程式为2Cu(NO3)2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+4NO2↑+O2↑.
Ⅲ.利用Cu(NO3)2制备浅绿色的碱式碳酸铜[CuCO3•Cu(OH)2].
向大试管中加入一定量的碳酸钠溶液和硝酸铜溶液,水浴加热,用0.4mol•L-1的NaOH溶液调节pH至8.5,振荡、静置、过滤、洗涤、干燥,得到样品.
【实验数据】反应温度对样品的影响
| 实验序号 | 1 | 2 | 3 | 4 |
| 温度/℃ | 35 | 50 | 70 | 95 |
| 样品颜色 | 深蓝色 | 深蓝色 | 浅绿色 | 暗蓝色 |
| 样品中碱式碳酸铜的质量分数/% | 90.9 | 92.7 | x | 92.0 |
(5)95℃时,样品颜色发暗的原因:含有黑色的氧化铜.
(6)70℃时,实验得到2.38g样品,取此样品加热至分解完全(杂质不分解),得到1.76g固体,此样品中碱式碳酸铜的质量分数是93.3%.
8.下列关于胶体的认识,错误的是( )
| A. | 是否能形成丁达尔效应是胶体和溶液最本质的区别 | |
| B. | 胶体微粒具有较大的表面积,能吸附阳离子或阴离子,故在电场作用下会产生电泳现象 | |
| C. | “雨后彩虹”“海市蜃楼”既是一种自然现象又是光学现象,也与胶体的知识有关 | |
| D. | 除去Fe(OH)3胶体中的FeCl3,可将混合物装入半透膜中,放入蒸馏水里 |
2.下列有关该实验的说法中正确的是( )
| A. | 除去硝基苯中混有的少量浓HNO3和H2SO4,可将其倒入到一定量的NaOH溶液中,振荡后静置分液 | |
| B. | 乙酸与丙烯酸属于同系物 | |
| C. | 聚丙烯酸能够使酸性高锰酸钾溶液褪色 | |
| D. | 除去乙烷中的乙烯,可通过酸性高锰酸钾溶液或溴水 |
9.下列物质固态时一定是分子晶体的是( )
| A. | 酸性氧化物 | B. | 碱性氧化物 | C. | 含氧酸 | D. | 非金属单质 |
6.下列有关试剂的保存方法,错误的是( )
| A. | 浓硝酸保存在无色玻璃试剂瓶中 | |
| B. | 少量的钠保存在煤油中 | |
| C. | NaOH溶液保存在具有玻璃塞的玻璃试剂瓶中 | |
| D. | 新制氯水保存在棕色玻璃试剂瓶中 |
7.电子表和电子计算机的电源通常用微型银锌电池,其电极分别为Ag2O和Zn,电解液为KOH溶液.电池总反应式为:Ag2O+H2O+Zn═Zn(OH)2+2Ag.下列叙述正确的是( )
| A. | Zn是正极,Ag2O是负极 | |
| B. | Zn(OH)2是负极,Ag是正极 | |
| C. | 工作时正极区溶液的pH增大 | |
| D. | 工作时电子由Ag2O极经外电路流向Zn极 |
 在酸性条件下水解后生成的有机物为
在酸性条件下水解后生成的有机物为 和CH3OH.
和CH3OH.