题目内容
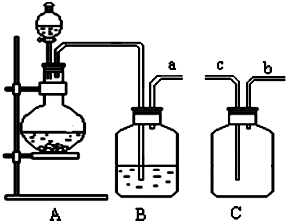
7.电子表和电子计算机的电源通常用微型银锌电池,其电极分别为Ag2O和Zn,电解液为KOH溶液.电池总反应式为:Ag2O+H2O+Zn═Zn(OH)2+2Ag.下列叙述正确的是( )| A. | Zn是正极,Ag2O是负极 | |
| B. | Zn(OH)2是负极,Ag是正极 | |
| C. | 工作时正极区溶液的pH增大 | |
| D. | 工作时电子由Ag2O极经外电路流向Zn极 |
分析 根据电池反应式Ag2O+Zn=2Ag+ZnO知,失电子的物质作负极,得电子的物质作正极,原电池放电时,电子从负极沿导线流向正极;根据电池电极附近氢离子或氢氧根离子浓度的变化判断溶液pH值的变化.
解答 解:A、电池反应式Ag2O+Zn=2Ag+ZnO中,较活泼的金属锌锌作负极,Ag2O是正极,故A错误;
B、电池反应式Ag2O+Zn=2Ag+ZnO中,较活泼的金属锌锌作负极,氧化银得电子发生还原反应,所以氧化银作正极,故B错误;
C、原电池放电时,正极的反应为Ag2O+2e-+H2O═2Ag+2OH-,所以正极附近氢氧根离子浓度增大,溶液的pH值增大,故C正确;
D、原电池放电时,电子从负极沿导线流向正极,则该原电池放电时,电子从锌沿导线流向氧化银,故D错误.
故选C.
点评 本题考查了原电池原理,难度不大,明确原电池正负极的判断方法、外电路中电子的流向、电极附近离子浓度的变化导致溶液pH值的变化即可解答本题.

练习册系列答案
相关题目
17.某实验室仅有如下仪器或用具:烧杯、铁架台、铁圈、三脚架、普通漏斗、石棉网、酒精灯、玻璃棒、量筒、蒸发皿、圆底烧瓶、滤纸、火柴.从缺乏仪器或用具的角度看,不能进行的实验操作项目是( )
| A. | 过滤 | B. | 蒸发 | C. | 萃取 | D. | 溶解 |
18.已知反应H2+I2═2HI,在一定条件下的数据如表,
根据数据判断该反应是放热反应(填“吸热”或“放热”).
| 化 学 键 | H-H | I-I | H-I |
| 断开或形成1mol化学键时的能量变化(kJ/mol) | 436 | 151 | 299 |
2.下列有关物质结构和性质的说法中,正确的是( )
| A. | 元素非金属性Cl>S的实验依据是酸性HCl>H2S | |
| B. | 碳元素的电负性小于氧元素,每个CO2分子中有4个σ键 | |
| C. | 同周期主族元素的原子形成的简单离子的电子层结构一定相同 | |
| D. | Na、Mg、Al三种元素,其第一电离能由大到小的顺序为Mg>Al>Na |
12.下列各组物质只需用一种试剂就可以区别开来的是( )
| A. | 乙烯、乙烷、乙炔、甲苯 | B. | 苯酚、乙酸、甲酸甲酯、乙醇 | ||
| C. | 硫酸钠、溴化钠、硫化钾、氯化钠 | D. | 苯、硝基苯、已烯、乙醇 |
19.下列说法不正确的是( )
| A. | 在4ml 0.1mol•L-1的K2Cr2O7溶液中滴加数滴1mol•L-1的NaOH溶液,溶液颜色从橙色变成黄色 | |
| B. | 实验时受溴腐蚀致伤,先用苯或甘油洗伤口,再用水洗 | |
| C. | 可用重结晶法提纯含少量NaCl的KNO3晶体 | |
| D. | 容量瓶、滴定管上都标有使用温度,“0”刻度;使用前水洗后滴定管还需润洗,而容量瓶不需要润洗 |
16.下列实验方案的设计、结论正确的是( )
| A. | 用 NaHCO3 溶液可一次鉴别出稀盐酸、NaOH溶液、AlCl3溶液、NaAlO2 溶液 | |
| B. | 高锰酸钾试剂瓶内壁上黑色物质可用稀盐酸洗涤 | |
| C. | 除去SO2 中少量HCl,将其通入饱和的Na2SO3 溶液 | |
| D. | 将NaOH溶液逐滴加入饱和FeCl3溶液制取Fe(OH)3胶体 |
17.为了回收废旧锂离子电池的正极材料试样(主要含有LiCoO2及少量Al、Fe等)可通过下列实验方法回收钴、锂.已知Co2+比Co3+稳定.下列叙述不正确的是( )
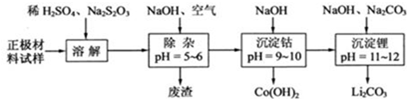

| A. | 在上述溶解过程中,S2O32-被氧化成SO42-,LiCoO2在溶解过程中发生的反应8LiCoO2+Na2S2O3+11H2SO4═4 Li2SO4+8CoSO4+Na2SO4+11H2O | |
| B. | 调整pH=5-6的目的是使Fe3+、Al3+转化为Fe(OH)3、Al(OH)3除去 | |
| C. | Co(OH)2沉淀完全后,溶液中不存在Co2+ | |
| D. | Li与Mg在周期表中处于对角线位置,性质有相似性,因此单质Li可用电解法回收 |