题目内容
12.某化学兴趣小组用铁矿石(主要成分为Fe2O3,还有SiO2、A12O3等杂质)提取Fe2O3.操作讨程如下:
(1)(I)和(Ⅱ)步骤中分离溶液和沉淀的操作名称是过滤.
(2)写出Fe2O3和盐酸反应的离子方程式Fe2O3+6H+═2Fe3++3H2O.
(3)沉淀A中主要含有SiO2,固体B是Fe2O3.
(4)滤液Y中的阴离子除OH-、Cl-外,还有AlO2- (写离子符号).
(5)过滤出氢氧化铁时需洗涤沉淀,洗涤沉淀的具体操作为:向漏斗中注入蒸馏水,使蒸馏水浸没沉淀,待水自然流完后,再加蒸馏水,重复2-3次,直至沉淀洗净为止.
分析 铁矿石(主要成分为Fe2O3,还有SiO2、A12O3等杂质)提取Fe2O3,由流程图可知,加入过量盐酸,氧化铁和氧化铝全部溶解为氯化铁和氯化铝溶液,二氧化硅不溶于盐酸,则沉淀A为SiO2;滤液X中加入过量氢氧化钠溶液,氯化铁全部反应生成氢氧化铁沉淀,氯化铝全部反应得到滤液Y中含偏铝酸钠和氯化钠、NaOH,氢氧化铁加热分解生成B为氧化铁,以此来解答.
解答 解:由流程图可知,加入过量盐酸,氧化铁和氧化铝全部溶解为氯化铁和氯化铝溶液,二氧化硅不溶于盐酸,则沉淀A为SiO2;滤液X中加入过量氢氧化钠溶液,氯化铁全部反应生成氢氧化铁沉淀,氯化铝全部反应得到滤液Y中含偏铝酸钠和氯化钠、NaOH,氢氧化铁加热分解生成B为氧化铁,
(1)(I)和(Ⅱ)步骤中分离溶液和沉淀的操作名称为过滤,故答案为:过滤;
(2)Fe2O3和盐酸反应生成铁离子和水,反应的离子方程式为Fe2O3+6H+═2Fe3++3H2O,故答案为:Fe2O3+6H+═2Fe3++3H2O;
(3)由上述分析可知A为SiO2,B为Fe2O3,故答案为:SiO2;Fe2O3;
(4)滤液Y是偏铝酸钠、氯化钠溶液,溶液中的阴离子除OH-、Cl-外,还有AlO2-,故答案为:AlO2-;
(5)洗涤沉淀,可向漏斗中注入蒸馏水,使蒸馏水浸没沉淀,待水自然流完后,再加蒸馏水,重复2-3次,直至沉淀洗净为止,
故答案为:向漏斗中注入蒸馏水,使蒸馏水浸没沉淀,待水自然流完后,再加蒸馏水,重复2-3次,直至沉淀洗净为止.
点评 本题考查混合物分离提纯的综合应用,为高频考点,把握流程中发生的反应及混合物分离方法为解答的关键,侧重分析与应用能力的综合考查,注意试剂过量及滤液成分的分析,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
3.下列反应的离子方程式书写正确的是( )
| A. | 稀盐酸与稀氨水反应:H++OH-═H2O | |
| B. | 溴化钠溶液与氯气反应:2Br-+Cl2=═Br2+2Cl- | |
| C. | 碳酸钙与醋酸反应:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | 二氧化氮与水反应:2NO2+2H2O═2H++2NO${\;}_{3}^{-}$+H2 |
20.通常状况下,将1g氢气在氯气中完全燃烧,放出92.4KJ热量,下列所示的热化学方程式正确的是( )
| A. | H2(g)+Cl2(g)=$\frac{1}{2}$HCl(g)△H=92.4KJ/mol | B. | H2(g)+Cl2(g)=$\frac{1}{2}$HCl(g)△H=-92.4KJ/mol | ||
| C. | H2(g)+Cl2(g)=2HCl(g)△H=-184.8KJ/mol | D. | H2(g)+Cl2(g)=2HCl(l)△H=184.8/mol |
17.化学与生产、生活息息相关,下列叙述错误的是( )
| A. | 明矾是常用的水处理剂,可以淡化海水 | |
| B. | 中国新型“鹘鹰”战斗机上使用的碳纤维是一种新型无机高分子材料 | |
| C. | “血液透析”利用了胶体的性质 | |
| D. | 葡萄酒中常添加极少量SO2,有防止葡萄酒氧化变质等作用 |
4.下列说法中正确的是( )
| A. | H2与O2的反应是熵增的放热反应 | |
| B. | 能说明盐酸是强酸的反应:HCl+AgNO3=AgCl↓+HNO3 | |
| C. | 向NaCl和KI的混合溶液中,逐滴加入AgNO3溶液,先产生黄色沉淀,则Ksp(AgCl)<Ksp(AgI) | |
| D. | 配制一定浓度的硫酸铝溶液时,应先加稀硫酸溶解硫酸铝固体,再稀释至所需浓度 |
2.某化妆品的组分Z具有美白功效,原料从杨树中提取,现可用如图反应制备,下列叙述错误的是( )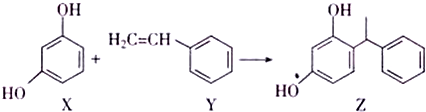

| A. | X、Y和Z均能使溴水褪色,且原理相同 | |
| B. | X和Z均能与Na2CO3溶液反应放出CO2 | |
| C. | Z中含手性碳原子 | |
| D. | Y可作加聚反应的单体,X可作缩聚反应的单体 |

 某品牌食品调料标签的一部分如图.
某品牌食品调料标签的一部分如图.