题目内容
下列叙述正确的是( )
| A、离子晶体中,只存在离子键,不可能存在其它化学键 |
| B、在氧族元素(O、S、Se、Te)的氢化物中,水的沸点最低 |
| C、NaHSO4、Na2O2晶体中的阴阳离子个数比均为1:2 |
| D、晶体的熔点:金刚石>碳化硅>单晶硅 |
考点:离子化合物的结构特征与性质,不同晶体的结构微粒及微粒间作用力的区别
专题:化学键与晶体结构
分析:A.离子晶体中可能存在共价键;
B.含有氢键的物质导致其沸点升高;
C.硫酸氢钠、过氧化钠中其阴离子分别是HSO4-、O22-;
D.原子晶体中,化学键的键长越长,其键能越小,熔点越低.
B.含有氢键的物质导致其沸点升高;
C.硫酸氢钠、过氧化钠中其阴离子分别是HSO4-、O22-;
D.原子晶体中,化学键的键长越长,其键能越小,熔点越低.
解答:
解:A.离子晶体中一定含有离子键,也可能存在共价键,故KOH,故A错误;
B.氧族元素的氢化物都是分子晶体,其溶沸点的高低取决于分子间作用力,水分子之间存在氢键使得其溶沸点特别高,所以水的沸点最高,故B错误;
C.硫酸氢钠、过氧化钠中其阴离子分别是HSO4-、O22-,其阳离子都是钠离子,所以NaHSO4中阴阳离子个数比是1:1,Na2O2晶体中的阴阳离子个数为1:2,故C错误;
D.这几种晶体都是原子晶体,且键长Si-Si>C-Si>C-C,所以键能Si-Si<C-Si<C-C,熔点金刚石>碳化硅>单晶硅,故D正确;
故选D.
B.氧族元素的氢化物都是分子晶体,其溶沸点的高低取决于分子间作用力,水分子之间存在氢键使得其溶沸点特别高,所以水的沸点最高,故B错误;
C.硫酸氢钠、过氧化钠中其阴离子分别是HSO4-、O22-,其阳离子都是钠离子,所以NaHSO4中阴阳离子个数比是1:1,Na2O2晶体中的阴阳离子个数为1:2,故C错误;
D.这几种晶体都是原子晶体,且键长Si-Si>C-Si>C-C,所以键能Si-Si<C-Si<C-C,熔点金刚石>碳化硅>单晶硅,故D正确;
故选D.
点评:本题涉及化学键、晶体熔点、氢键等知识点,根据化学键与化合物的关系、化学键键能与键长的关系、物质的构成微粒等知识点来分析解答,易错选项是C,注意硫酸氢钠在水溶液里和熔融状态下电离的差异,为易错点.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列图示实验现象及其解释不正确的是( )
A、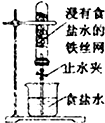 一段时间后打开止水夹,观察到导管中液面上升,因为铁发生了吸氧腐蚀 |
B、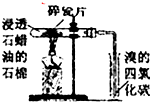 加热一段时间,观察到溴的四氯化碳溶液颜色褪去,因为有气态烯烃产生 |
C、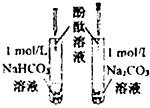 溶液均变红,碳酸钠溶液颜色较深,因为相同条件下水解能力HCO3-强于CO32- |
D、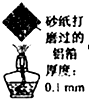 加热一段时间,观察到熔化的铝未滴落,因为铝表面生成氧化铝的熔点很高 |
下列说法正确的是( )
| A、可用使铁钝化的方法来减缓铁的腐蚀 |
| B、除去CO气体中的少量氧气可让气体通过加热的铜网 |
| C、不论将铝箔加热到什么样的温度均是只熔化而不滴落下来 |
| D、等质量的铝与盐酸或氢氧化钠溶液反应时产生的氢气体积一定相等 |
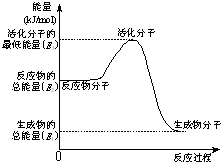 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是①CH3OH(g)+H2O(g)→CO2(g)+3H2(g)-49.0kJ
②CH3OH(g)+
| 1 |
| 2 |
下列说法正确的是( )
| A、上述图示的反应为吸热反应 |
| B、图中的能量变化如图所示,则Q=E3-E1 |
| C、H2燃烧能放出大量的热,故CH3OH转变成H2的过程必须吸收热量 |
| D、根据①②推知:在25℃,101kPa时,1mol CH3OH(g)完全燃烧生成CO2和H2O放出的热量应676.7kJ |
青霉素是一元有机酸,它的钠盐的1国际单位的质量为6.00×10-7克,它的钾盐1国际单位的质量为6.27×10-7克,(1国际单位的2种盐的物质的量相等),则青霉素的相对分子质量为( )
| A、371.6 |
| B、355.6 |
| C、333.6 |
| D、332.6 |
下列说法正确的是( )
| A、所谓低碳经济,是指在可持续发展理念指导下,尽可能地减少光化学污染气体的排放 |
| B、汽油、柴油和植物油都是碳氢化合物 |
| C、只由一种元素组成的物质,一定是纯净物 |
| D、化学反应的实质就是旧化学键的断裂、新化学键形成过程 |
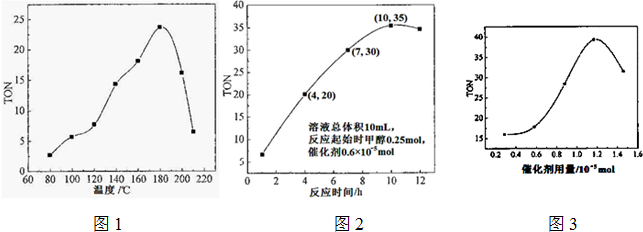
 氨和肼(N2H4)是氮的两种常见氢化物,在科学技术和生产中有重要的应用.
氨和肼(N2H4)是氮的两种常见氢化物,在科学技术和生产中有重要的应用.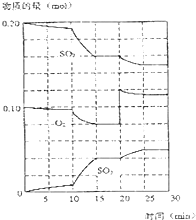 在一定条件下,二氧化碳和氧气发生如下反应:
在一定条件下,二氧化碳和氧气发生如下反应: