题目内容
20.Cl2O为国际公认高效安全灭菌消毒剂之一,它是棕黄色强刺激性气体,沸点3.8℃,熔点-116℃.实验室可用潮湿的Cl2与Na2CO3反应制取少量Cl2O,装置如下(图Ⅰ):
回答下列问题:
(1)把浓盐酸直接滴在KMnO4晶体上就可以产生Cl2.请模仿“图Ⅱ”在“图Ⅰ”A处补画出正确的装置图,并作必要的标注
(2)B中试剂a应选用b(填下列序号字母):
a.CCl4 b.饱和NaCl溶液 c.浓H2SO4d.饱和NaHCO3溶液
(3)通入适量的氯气,在C中生成黄绿色的物质Cl2O,该物质常温为气体,方程式为:
2Cl2+2Na2CO3+H2O═2NaHCO3+2NaCl+1Cl2O
(4)对C中反应后的固体成分进行检验,请写出实验步骤以及预期的现象和结论.
限选实验试剂和仪器:蒸馏水、稀HNO3、BaCl2溶液、Ba(OH)2溶液、AgNO3溶液、澄清石灰水、试管、小烧杯、带导管的橡皮塞、过滤装置.
| 实验步骤 | 现象和结论 |
| 步骤一:取C中的少量固体样品于试管中,滴加足量蒸馏水至完全溶解,然后将溶液分别置于a、b试管中. | |
| 步骤二:向a试管中滴加BaCl2溶液,静置. | 无明显现象,证明固体中不含Na2CO3 |
| 步骤三:取a试管的上层清液于c试管中取a试管的上层清液于c试管中加入适量氢氧化钡溶液 | 产生白色沉淀证明固体中含有碳酸氢钠 |
| 步骤四:向试管b中加入过量稀硝酸溶液向试管b中加入过量稀硝酸溶液再滴加少量硝酸银溶液 | 有白色沉淀生成 则证明固体中含有NaCl |
分析 (1)反应是固体和液体不加热制取气体,液体从分液漏斗加入,固体在锥形瓶内加入高锰酸钾固体,导气管露出胶塞,导气管接B装置胶皮管,画出装置图;
(2)浓盐酸易挥发,制备的氯气中含有氯化氢,依据氯气与氯化氢水溶性选择除杂剂;
(3)依据氧化还原反应的元素化合价变化,结合电子守恒和原子守恒确定空项物质,配平书写;
(4)依据实验步骤和反应现象,结合物质性质选择试剂,判断反应现象得到结论;
解答 解:(1)把浓盐酸直接滴在KMnO4晶体上就可以产生Cl2.反应是固体和液体不加热制取气体,液体从分液漏斗加入,固体在锥形瓶内加入高锰酸钾固体,导气管露出胶塞,导气管接B装置胶皮管,画出装置图为: ;
;
故答案为: ;
;
(2)浓盐酸易挥发,制备的氯气中含有氯化氢,氯化氢易溶于水,氯气在饱和食盐水中溶解度不大,可以选择饱和食盐水除去氯气中的氯化氢;
故答案为:b;
(3)反应中部分氯元素化合价升高:0→+1价,部分氯元素化合价降低:0→-1价,依据氧化还原反应得失电子守恒,氯化钠系数为2,Cl2O系数为1,依据原子个数守恒,反应方程式:2Cl2+2Na2CO3+H2O=2NaHCO3+2NaCl+Cl2O;
故答案为:2,2,H2O,2,2,1;
(4)对C中反应后的固体成分进行检验,乙实验的方法测定是否含有碳酸钠,碳酸氢钠,氯化钠,依据题干实验步骤,步骤二加入氯化钡检验碳酸钠的存在;步骤三利用酸和碳酸氢钠反应生成碳酸钠,在溶液中和钡离子反应生成白色沉淀证明碳酸氢钠的存在;步骤四加入过量稀硝酸排除其他离子的干扰,加入硝酸银生成白色沉淀判断氯化钠的存在;
故答案为:
| 实验步骤 | 现象和结论 |
| 步骤三:取a试管的上层清液于c试管中加入适量氢氧化钡溶液 | 产生白色沉淀证明固体中含有碳酸氢钠 |
| 步骤四:向试管b中加入过量稀硝酸溶液再滴加少量硝酸银溶液 | 有白色沉淀生成 |
点评 本题考查了实验制取氯气的方法和装置选择,产物判断及验证,熟悉实验原理,明确物质的性质是解题关键,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
11.下列说法正确的是( )
| A. | 乙醇既可以发生催化氧化反应,又可以发生酯化反应 | |
| B. | 用溴水可以鉴别乙醇、乙酸和苯 | |
| C. | 糖类、油脂、蛋白质三类物质都只含有C、H、O三种元素 | |
| D. | C5H10O属于醛类的同分异构体为六种 |
8. 某同学将电解池工作时电子、离子流动方向及电极种类等信息表示在如图中,下列有关分析完全正确的是
某同学将电解池工作时电子、离子流动方向及电极种类等信息表示在如图中,下列有关分析完全正确的是
( )
 某同学将电解池工作时电子、离子流动方向及电极种类等信息表示在如图中,下列有关分析完全正确的是
某同学将电解池工作时电子、离子流动方向及电极种类等信息表示在如图中,下列有关分析完全正确的是( )
| A | B | C | D | |
| a电极 | 阳极 | 阴极 | 阳极 | 阴极 |
| d电极 | 正极 | 正极 | 负极 | 负极 |
| Q离子 | 阳离子 | 阳离子 | 阴离子 | 阴离子 |
| A. | A | B. | B | C. | C | D. | D |
15.工业上用固体硫酸亚铁制取颜料铁红(Fe2O3),还产生一种有刺激性气体,并能使品红试液褪色的物色气体,且已知该气体与Fe2O3的物质的量之比为1:1,除此之外还有一种产物,该产物为( )
| A. | Fe | B. | O2 | C. | SO3 | D. | FeO |
12. 某温度下,在容积为2L的密闭容器中充入1mol CO2和3.25mol H2,在一定条件下反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化关系如图所示.下列说法错误的是( )
某温度下,在容积为2L的密闭容器中充入1mol CO2和3.25mol H2,在一定条件下反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化关系如图所示.下列说法错误的是( )
 某温度下,在容积为2L的密闭容器中充入1mol CO2和3.25mol H2,在一定条件下反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化关系如图所示.下列说法错误的是( )
某温度下,在容积为2L的密闭容器中充入1mol CO2和3.25mol H2,在一定条件下反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化关系如图所示.下列说法错误的是( )| A. | 该反应的化学方程式为CO2+3H2?CH3OH+H2O | |
| B. | 从反应开始到3 min时,氢气的平均反应速率v(H2)=0.25 mol•L-1•min-1 | |
| C. | 在原容器中再充入1 mol H2能使CO2的转化率增大 | |
| D. | 恒温下,向反应体系中加入固体催化剂,反应产生的热量增加 |
9.从废钒催化剂(主要成分V2O5、VOSO4、K2SO4、SiO2和Fe2O3等)中回收V2O5的一种生产工艺流程示意图如下:
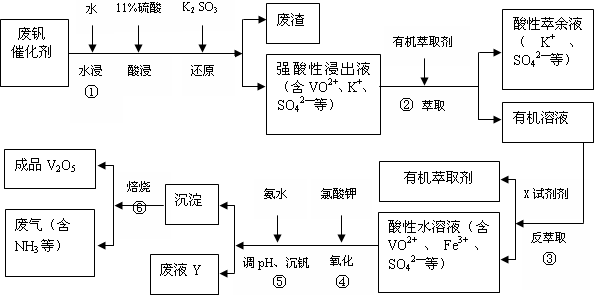
(1)①中废渣的主要成分是SiO2.
(2)②、③中的变化过程可简化为(下式中的R表示VO2+或Fe3+,HA表示有机萃取剂的主要成分):R2(SO4)n(水层)+2n HA(有机层) 2RAn(有机层)+n H2SO4(水层).
②中萃取时必须加入适量碱,其原因是加入碱中和产生的酸,平衡右移,提高钒的萃取率;
③中反萃取时加入的X试剂是硫酸.
(3)完成④中反应的离子方程式:
1ClO3-+6VO2++6H+═6VO3++1(Cl-)+3(H2O)
(4)25℃时,取样进行实验分析,得到钒沉淀率和溶液pH之间的关系如表
试判断在实际生产时,⑤中加入氨水调节溶液的最佳pH为1.7;若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)<2.6×10-3.(已知:25℃时,Ksp(Fe(OH)3)=2.6×10-39.)
(5)写出废液Y中除H+之外的两种阳离子:Fe3+、VO3+、NH4+、K+(任写两种即可).
(6)生产时,将②中的酸性萃余液循环用于①中的水浸.在整个工艺过程中,可以循环利用的物质还有有机萃取剂、氨水(或氨气).
(7)全矾液流电池是一种新型电能储存和高效转化装置(如图所,a、b均为惰性电极),已知:V2+为紫色,V3+为绿色,VO2+为蓝色,VO2+为黄色.当充电时,右槽溶液颜色由绿色变为紫色.则:
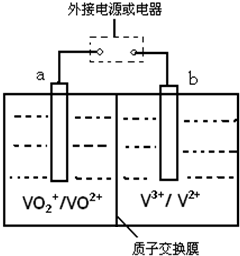
①全矾液流电池的工作原理为:
VO2++V2++2H+ $?_{()电}^{()电}$ VO2++H2O+V3+
(请在可逆符号两侧的括号中填“充”、“放”)
②放电过程中,a极的反应式为VO2++2H++e-=VO2++H2O;当有1.0mol电子时共有1.0mol H+从右槽迁移进左槽(填“左”、“右”)

(1)①中废渣的主要成分是SiO2.
(2)②、③中的变化过程可简化为(下式中的R表示VO2+或Fe3+,HA表示有机萃取剂的主要成分):R2(SO4)n(水层)+2n HA(有机层) 2RAn(有机层)+n H2SO4(水层).
②中萃取时必须加入适量碱,其原因是加入碱中和产生的酸,平衡右移,提高钒的萃取率;
③中反萃取时加入的X试剂是硫酸.
(3)完成④中反应的离子方程式:
1ClO3-+6VO2++6H+═6VO3++1(Cl-)+3(H2O)
(4)25℃时,取样进行实验分析,得到钒沉淀率和溶液pH之间的关系如表
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率/% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
(5)写出废液Y中除H+之外的两种阳离子:Fe3+、VO3+、NH4+、K+(任写两种即可).
(6)生产时,将②中的酸性萃余液循环用于①中的水浸.在整个工艺过程中,可以循环利用的物质还有有机萃取剂、氨水(或氨气).
(7)全矾液流电池是一种新型电能储存和高效转化装置(如图所,a、b均为惰性电极),已知:V2+为紫色,V3+为绿色,VO2+为蓝色,VO2+为黄色.当充电时,右槽溶液颜色由绿色变为紫色.则:

①全矾液流电池的工作原理为:
VO2++V2++2H+ $?_{()电}^{()电}$ VO2++H2O+V3+
(请在可逆符号两侧的括号中填“充”、“放”)
②放电过程中,a极的反应式为VO2++2H++e-=VO2++H2O;当有1.0mol电子时共有1.0mol H+从右槽迁移进左槽(填“左”、“右”)
 .
. Na2O2可用作漂白剂和呼吸面具中的供氧剂.
Na2O2可用作漂白剂和呼吸面具中的供氧剂. 在某一容积为5L的密闭容器内,加入0.2molCO和0.2molH2O,在催化剂存在的条件下高温加热,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H>0,反应中CO2的浓度随时间变化情况如图所示:
在某一容积为5L的密闭容器内,加入0.2molCO和0.2molH2O,在催化剂存在的条件下高温加热,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H>0,反应中CO2的浓度随时间变化情况如图所示: