题目内容
11.下列叙述正确的是( )| A. | 同周期元素的原子半径以ⅦA族的为最大 | |
| B. | 在周期表中0族元素的单质全部是气体 | |
| C. | ⅠA、ⅡA族元素的原子,其半径越大越容易失去电子,第一电离能越大 | |
| D. | 所有主族元素的原子形成单核离子时的价数都和它的族数相等 |
分析 A.同周期自左而右原子半径减小;
B.零族元素单质都是气体;
C.同主族自上而下原子半径增大,元素失去电子的能力增强;
D.阴离子化合价不都等于其族序数.
解答 解:A.同周期自左而右原子半径减小,故同周期中ⅦA族元素原子半径最小,故A错误;
B.氦、氖、氩、氪、氙、氡都是气体,故B正确;
C.同主族原子半径越大,原子核对核外电子吸引越弱,越容易失去电子,第一电离能越小,故C错误;
D.所有主族元素的原子形成单原子阳离子时的化合价等于其族序数,但形成阴离子时的化合价不一定等于其族序数,如氧离子、氯离子,故D错误,
故选B.
点评 本题考查元素周期表与元素周期律,比较基础,侧重元素周期律的考查,注意对基础知识的理解掌握.

练习册系列答案
相关题目
2.25℃时,已知Ksp(Ag2SO4)=1.2×10-5,Ksp(AgCl)=1.8×10-10,Ksp(Ag2C2O4)=3.5×10-11,Ksp(AgI)=1.5×10-16,该温度下有关叙述正确的是( )
| A. | AgCl、Ag2C2O4、AgI三者的饱和溶液中c(Ag+)大小顺序:Ag2C2O4>AgCl>AgI | |
| B. | 将0.02mol•L-1AgNO3溶液和0.02mol•L-1Na2SO4溶液等体积混合,有沉淀生成 | |
| C. | 向5mL饱和AgCl溶液中滴加0.5mL0.1mol•L-1KI溶液,无沉淀生成 | |
| D. | 向浓度均为0.1mol•L-1NaCl和KI混合溶液中滴加AgNO3溶液,先有白色沉淀生成 |
19.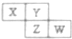 X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法正确的是( )
 X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法正确的是( )| A. | X的气态氧化物比Y的稳定 | |
| B. | X与Y形成的化合物都易溶于水 | |
| C. | Z与Y只能形成ZY3型化合物 | |
| D. | W的最高价氧化物对应水化物的酸性比Z的强 |
16.某化学小组以苯甲酸为原料,制取苯甲酸甲酯,已知有关物质的沸点如表:
I.合成苯甲酸甲酯粗产品
(1)甲和乙两位同学分别设计了如图所示的两套实验室合成苯甲酸甲酯的装置(夹持仪器和加热仪器均已略去).根据有机物的沸点,最好采用甲(填“甲”或“乙”)装置.理由是甲中有冷凝回流装置.
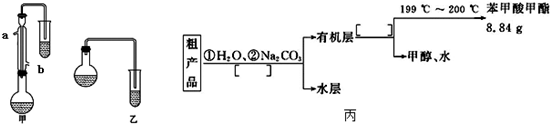
(2)实验中浓硫酸的作用是催化剂、吸水剂冷凝水应从b(填“a”或“b”,下同)口进,a口出.
(3)反应物CH3OH应过量,理由是为了提高苯甲酸甲酯的产率;两套装置中导管末端均没有伸入到试管液面以下的原因防止倒吸.
Ⅱ.粗产品的精制
(4)苯甲酸甲酯粗产品中往往含有少量甲醇、苯甲酸和水等,现拟用下列流程图进行精制,请在流程图丙中方括号内填入操作方法的名称.
| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 64.7 | 249 | 199.6 |
(1)甲和乙两位同学分别设计了如图所示的两套实验室合成苯甲酸甲酯的装置(夹持仪器和加热仪器均已略去).根据有机物的沸点,最好采用甲(填“甲”或“乙”)装置.理由是甲中有冷凝回流装置.

(2)实验中浓硫酸的作用是催化剂、吸水剂冷凝水应从b(填“a”或“b”,下同)口进,a口出.
(3)反应物CH3OH应过量,理由是为了提高苯甲酸甲酯的产率;两套装置中导管末端均没有伸入到试管液面以下的原因防止倒吸.
Ⅱ.粗产品的精制
(4)苯甲酸甲酯粗产品中往往含有少量甲醇、苯甲酸和水等,现拟用下列流程图进行精制,请在流程图丙中方括号内填入操作方法的名称.
3.毒奶粉主要是奶粉中含有有毒的三聚氰胺( ).下列关于三聚氰胺分子的说法中正确的是( )
).下列关于三聚氰胺分子的说法中正确的是( )
 ).下列关于三聚氰胺分子的说法中正确的是( )
).下列关于三聚氰胺分子的说法中正确的是( )| A. | 所有氮原子均采取sp3杂化 | |
| B. | 一个三聚氰胺分子中共含有15个σ键 | |
| C. | 属于极性分子 | |
| D. | 三聚氰胺分子中同时含有极性键和非极性键 |
20.下列说法中不正确的是( )
| A. | 同位素示踪法是科学家研究化学反应历程的重要手段之一 | |
| B. | 开发核能、太阳能等新能源,推广乙醇汽油,使用无磷洗涤剂都可直接降低碳排放量 | |
| C. | 红外光谱仪、核磁共振仪、质谱仪都可用于有机化合物结构的分析 | |
| D. | 尼龙、棉花、天然橡胶、ABS树脂都是由高分子化合物组成的物质 |
1.桶烯的结构简式如图所示,下列有关说法不正确的是( )


| A. | 桶烯分子中所有的原子都在同一平面上 | |
| B. | 桶烯在一定条件下能发生加聚反应 | |
| C. | 桶烯与苯乙烯互为同分异构体 | |
| D. | 桶烯中的一个氢原子被氯原子取代,所得产物只有两种 |
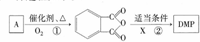
 )是一种酯类塑化剂,DMP的蒸气对氢气的相对密度为97.工业上生产 DMP的工艺流程如图所示:
)是一种酯类塑化剂,DMP的蒸气对氢气的相对密度为97.工业上生产 DMP的工艺流程如图所示: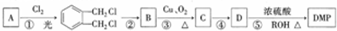
 .
. .
.
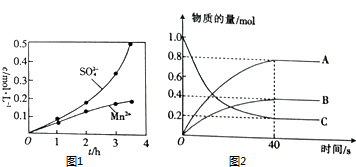 硫及其化合物在药物、造纸、炸药及石油加工等方面具有广泛应用.回答下列问题:
硫及其化合物在药物、造纸、炸药及石油加工等方面具有广泛应用.回答下列问题: