题目内容
某无色透明溶液中,加入BaCl2溶液生成不溶于稀 HNO3的白色沉淀,则该溶液中一定大量存在( )
| A、Ag+ |
| B、SO42- |
| C、SO42-和Ag+ |
| D、SO42-或Ag+ |
考点:离子共存问题
专题:离子反应专题
分析:无色透明溶液中,加入BaCl2溶液生成不溶于稀 HNO3的白色沉淀,沉淀为AgCl或硫酸钡,但二者不能同时存在,以此来解答.
解答:
解:无色透明溶液中,加入BaCl2溶液生成不溶于稀 HNO3的白色沉淀,沉淀为AgCl或硫酸钡,则原无色溶液中可能含Ag+,或含SO42-,但二者不能同时存在,
故选D.
故选D.
点评:本题考查离子的共存及离子的检验,为高频考点,把握白色沉淀为氯化银或硫酸钡为解答的关键,注意硫酸银不溶于水,银离子与硫酸根离子不能共存,题目难度不大.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A、2.4g金属镁所含电子数目为0.2NA |
| B、16gCH4所含原子数目为NA |
| C、17gNH3所含电子数目为NA |
| D、18g水所含分子数目为NA |
常温下,下列各溶液中微粒的物质的量浓度关系正确的是( )
| A、0.1 mol?L-1的Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3) |
| B、NaA溶液的pH=8,c(Na+)-c(A-)=9.9×10-7 mol?L-1 |
| C、将0.1mol/L的Na2S溶液与0.1mol/L的NaHS溶液等体积混合,所得溶液中:c(OH-)=c(H+)+c(S2-)+2c(HS-)+3c(H2S) |
| D、将25mL0.2mol/L的盐酸与100mL0.1mol/L的氨水混合,所得溶液中:c(Cl-)>c(NH4+)>c(NH3?H2O)>c(OH-)>c(H+) |
16O中的16表示的含义是( )
| A、氧元素的相对原子质量 |
| B、氧元素的一种同位素的近似相对原子质量 |
| C、氧元素的近似相对原子质量 |
| D、氧元素的一种同位素的质量数 |
下列离子方程式书写正确的是( )
| A、将铁放入氯化铁溶液中:Fe+Fe3+═2Fe2+ |
| B、向新制的氢氧化亚铁中加入足量的稀硝酸:Fe(OH)2+2H+═Fe2++2H2O |
| C、将少量的二氧化硫通入氢氧化钠溶液中:SO2+2OH-═SO32-+H2O |
| D、向氯化铝溶液中加入过量的氢氧化钠溶液:Al3++3OH-═Al(OH)3↓ |

 表示(其中X、Y均不为氢):写出符合上述通式且能发生银镜反应的四种物质的结构简式
表示(其中X、Y均不为氢):写出符合上述通式且能发生银镜反应的四种物质的结构简式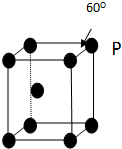 A、B、C、D、E五种元素其核电荷数依次增大.A原子只有1个s电子,B原子L层中s电子和p电子数目相同,B、C、D属于同周期且相邻,E原子内层均饱和,N层上只有两个电子.
A、B、C、D、E五种元素其核电荷数依次增大.A原子只有1个s电子,B原子L层中s电子和p电子数目相同,B、C、D属于同周期且相邻,E原子内层均饱和,N层上只有两个电子.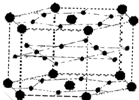 A、B、C、D、E、F六种元素,A、B、C属于第四周期且单质均为固体.基态时,A、B原子核外电子均成对,且核电荷数A>B,原子半径A<B;C与A在周期表属于同一区的元素,原子半径接近.如图是金属B和C所形成的某种合金的晶胞结构示意图;D、E、F在周期表中属于同一区,D原子在基态时p轨道半充满且电负性是同族元素中最大的;E的逐级电离能数据有两次突跃,E原子的第一电离能至第四电离能(kJ/mol)分别为:578、1817、2745、11575;F原子有三个能层,E与F能形成原子数目比为1:3,熔点为190℃的化合物Q.请回答:
A、B、C、D、E、F六种元素,A、B、C属于第四周期且单质均为固体.基态时,A、B原子核外电子均成对,且核电荷数A>B,原子半径A<B;C与A在周期表属于同一区的元素,原子半径接近.如图是金属B和C所形成的某种合金的晶胞结构示意图;D、E、F在周期表中属于同一区,D原子在基态时p轨道半充满且电负性是同族元素中最大的;E的逐级电离能数据有两次突跃,E原子的第一电离能至第四电离能(kJ/mol)分别为:578、1817、2745、11575;F原子有三个能层,E与F能形成原子数目比为1:3,熔点为190℃的化合物Q.请回答:

 (-R、-R′、-R″表示可能相同或可能不同的原子或原子团)
(-R、-R′、-R″表示可能相同或可能不同的原子或原子团) 有多种同分异构体,符合下列要求的有
有多种同分异构体,符合下列要求的有