题目内容
8.下列关于有机物的说法中,正确的是( )| A. | 可用工业酒精配制饮用酒和调味用的料酒 | |
| B. | 食用白糖的主要成分是蔗糖 | |
| C. | 医用酒精的浓度通常为95% | |
| D. | 液化石油气的主要成分是甲烷 |
分析 A.工业酒精含有甲醇,甲醇有毒;
B.白糖的成分为蔗糖;
C.医用酒精的浓度通常为75%;
D.根据液化石油气的主要成分分析.
解答 解:A.工业酒精含有甲醇,甲醇有毒,不能饮用,故A错误;
B.食用白糖的主要成分是蔗糖,具有甜味,为常见的二糖,故B正确;
C.医用酒精的浓度通常为75%,故C错误;
D.液化石油气的主要成分是丙烷(C3H8)和丁烷(C4H10),故D错误;
故选:B.
点评 本题考查了元素化合物知识,侧重考查物质的组成及用途,明确相关物质的成分是解题关键,题目难度不大.

练习册系列答案
相关题目
18.下列除去杂质的操作中不正确的是( )
| A. | CuO中混有Al2O3:加入过量烧碱溶液充分反应后过滤 | |
| B. | FeCl2溶液中混有CuCl2:加入过量铁粉充分反应后过滤 | |
| C. | Na2CO3固体中混有少量NaHCO3:加入过量NaOH溶液,反应后加热蒸干 | |
| D. | 乙烷中混有乙烯:将混合气体通过盛溴水的洗气瓶 |
19.下列说法正确的是( )
| A. | 6.02×1023就是阿伏加德罗常数 | |
| B. | 1mol氧含 6.02×1023个 O2 | |
| C. | 1mol任何气体所含的气体分子数目都相等 | |
| D. | 摩尔是国际单位制中的一个基本物理量 |
16.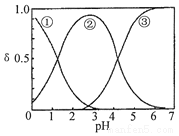 H2C2O4水溶液中H2C2O4、HC2O4-和C2O42-三种形态的粒子的分布分数δ随溶液pH变化的关系如图所示,下列说法正确的是( )
H2C2O4水溶液中H2C2O4、HC2O4-和C2O42-三种形态的粒子的分布分数δ随溶液pH变化的关系如图所示,下列说法正确的是( )
 H2C2O4水溶液中H2C2O4、HC2O4-和C2O42-三种形态的粒子的分布分数δ随溶液pH变化的关系如图所示,下列说法正确的是( )
H2C2O4水溶液中H2C2O4、HC2O4-和C2O42-三种形态的粒子的分布分数δ随溶液pH变化的关系如图所示,下列说法正确的是( )| A. | 曲线①代表的粒子是HC2O4- | |
| B. | 0.1mol•L-1NaHC2O4溶液中:c(C2O42-)>c(H2C2O4) | |
| C. | pH=5时,溶液中主要含碳微粒浓度大小关系为:c(C2O42-)>c(H2C2O4)>c(HC2O4-) | |
| D. | 在一定温度下,往CaC2O4饱和溶液中加入少量CaCl2固体,c(C2O42-)将减小,c(Ca2+)增大 |
3.下列有关叙述中不正确的是( )
| A. | 将SO2通入Ba(OH)2溶液中,有白色沉淀生成,加过量的稀盐酸后沉淀消失 | |
| B. | 将SO2通入BaCl2溶液中,有白色沉淀生成,加稀盐酸后沉淀消失 | |
| C. | 将SO2通入Ba(OH)2溶液中,有白色沉淀生成,加过量的稀硝酸后沉淀不消失 | |
| D. | 将SO2通入硝酸酸化的BaCl2溶液中,有白色沉淀生成,加稀盐酸后沉淀不消失 |
13.利用如图所示装置进行下列实验,装置正确并能达到实验目的是( )
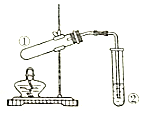

| 选项 | ①中试剂 | ②中溶液 | 实验目的 |
| A | 二氧化锰(s),浓盐酸 | 饱和食盐水 | 制取氯气 |
| B | Na2SO3(s),70%H2SO4 | 酸性高锰酸钾 | 验证SO2的还原性 |
| C | Na2CO3(s)或NaHCO3(s) | 澄清石灰水 | 鉴别Na2CO3和NaHCO3 |
| D | 乙醇、乙酸、浓硫酸 | 饱和碳酸钠 | 制取乙酸乙酯 |
| A. | A | B. | B | C. | C | D. | D |
7.下列溶液氯离子的物质的量浓度与50mL 1mol•L-1AlCl3溶液中氯离子的物质的量浓度相等的是( )
| A. | 150 mL 1 mol•L-1氯化钠溶液 | B. | 75 mL 3 mol•L-1氯化钙溶液 | ||
| C. | 150 mL 3 mol•L-1氯化钾溶液 | D. | 50 mL 3 mol•L-1氯化镁溶液 |
4.下列说法错误的是( )
| A. | 焰色反应与电子跃迁有关 | |
| B. | P4和CH4都是正四面体分子且键角都为109°28′ | |
| C. | 元素电负性越大的原子,吸引电子的能力越强 | |
| D. | 根据对角线规则,H3BO3是弱酸 |
5.下列说法正确的是( )
| A. | 22.4LN2含阿伏加德罗常数个氮分子 | |
| B. | 在标准状况下,11.2 L四氯化碳所含分子数为0.5NA | |
| C. | 22g二氧化碳与标准状况下11.2LH2含有相同的原子数 | |
| D. | 常温常压下,5.6g铁与过量的盐酸反应转移电子总数为0.2NA |