题目内容
11.请回答下列问题:(1)-定温度下,向0.1mol/LCH3COOH溶液中加入少量CH3COONa晶体时,下列说法正确的是bcd.(填代号)
a.溶液的pH减小 b.CH3COOH的电离程度减小
c.溶液的导电能力增强 d.溶液中c(OH-)•c(H+)不变
(2 )25°C 时,0.10mol/L Na2C03 溶液的 pH=11,则溶液中由水电离出的 c(OH-)=10-3mol/L.
(3)己知快Ksp只与温度有关,溶解平衡:CaC03(s)?Ca2++(aq)+A2-(aq)△H>0.
①温度升高时,Ksp增大.(填“增大”“减小”或“不变”,下同)
②向浊液中通入HCl气体c( Ca2+)增大
(4)己知醋酸的电离常数k=1.8×l05.25°C时,向CH3COOH溶液中加入一定量的NaHC03,所得混合液的 pH=6,则混合液中 c(CH3COO-)/c(CH3COOH)=18.
分析 (1)CH3COOH溶液加入少量CH3COONa晶体时平衡向逆反应方向移动,电离程度减小,c(H+)减小,c(OH-)增大,溶液的PH增大,导电能力增强;
(2)Na2C03溶液中Kw=c(OH-)•c(H+),据此计算回答;
(3)①该反应为吸热反应,温度升高,平衡正向移动,然后判断Ksp;
②加盐酸,促进难溶盐的电离,使平衡向正反应方向移动;
(4)据醋酸的电离平衡常数K=$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$=1.8×10-5和pH=6求算.
解答 解:(1)CH3COOH溶液加入少量CH3COONa晶体时平衡向逆反应方向移动,电离程度减小,c(H+)减小,c(OH-)增大,溶液的PH增大,导电能力增强;
a、CH3COOH溶液加入少量CH3COONa晶体时平衡向逆反应方向移动,电离程度减小,c(H+)减小,溶液的PH增大,故错误;
b、CH3COOH溶液加入少量CH3COONa晶体时平衡向逆反应方向移动,电离程度减小,故正确;
c、CH3COOH溶液加入少量CH3COONa晶体时平衡向逆反应方向移动,电离程度减小,c(H+)减小,c(OH-)增大,溶液的PH增大,导电能力增强,故正确;
d、溶液中Kw=c(OH-)•c(H+)是一个定值,只随着温度的变化而变化,温度不变,Kw不变,故正确.
故选bcd;
(2)0.10mol/L Na2C03溶液中Kw=c(OH-)•c(H+)的,根据pH=11,得到c(OH-)=10-3mol/L,级溶液中由水电离出的 c(OH-)=10-3mol/L,故答案为:10-3;
(3)①该反应为吸热反应,温度升高,平衡正向移动,Ksp增大,故答案为:增大;
②加HCl发生反应:A2-+H+?HA-,A2-浓度减小,CaA的溶解平衡向右移动,n(Ca2+)显著增大,而溶液体积几乎不变化,所以c(Ca2+)增大,
故答案为:增大;
(4)醋酸的电离平衡常数K=$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$=1.8×10-5,pH=6,则c(H+)=10-6mol/L,所以c(CH3COO-)/c(CH3COOH)=$\frac{1.8×1{0}^{-5}}{1{0}^{-6}}$=18,
故答案为:18.
点评 本题考查了弱电解质的电离平衡、水的离子积常数及应用、弱电解质的电离平衡常数及应用,题目难度中等.

 阅读快车系列答案
阅读快车系列答案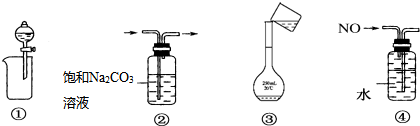
| A. | ①分离出BaSO4浊液中的BaSO4 | B. | ②除去CO2中少量HCl气体 | ||
| C. | ③将溶液转移到容量瓶中 | D. | ④排水法收集NO |

| A. | Al(OH)3 | B. | Al2O3 | C. | HCO3- | D. | CO2 |
| A. | 咖啡加糖 | B. | 炒菜加味精 | ||
| C. | 酱油加铁强化剂 | D. | 加工食品加防腐剂 |
| A. | O2 | B. | HCl | C. | NH3 | D. | Cl2 |
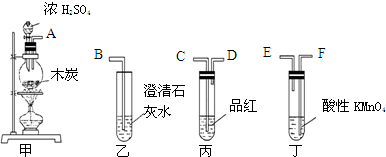
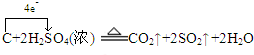 .
.



 3C(g)+D(g)达到平衡时,C的浓度为Wmol/L,若维持容器体积和温度不变,按下列四种方法改变起始物质,达到平衡后,C的浓度仍为Wmol/L的是( )
3C(g)+D(g)达到平衡时,C的浓度为Wmol/L,若维持容器体积和温度不变,按下列四种方法改变起始物质,达到平衡后,C的浓度仍为Wmol/L的是( )