题目内容
12.如图是利用一种微生物将废水中的有机物(假设是淀粉)的化学能直接转化为电能,并利用此电能在铁上镀铜,下列说法中正确的是( )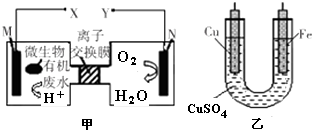
| A. | 铜电极应与X相连接 | |
| B. | H+透过离子交换膜由N极向M极移动 | |
| C. | M电极反应式:(C6H10O5)n+7n H2O-24n e-═6n CO2↑+24n H+ | |
| D. | 当N电极消耗0.25 mol气体时,则铁电极增重16 g |
分析 根据题给信息知,该装置是将化学能转化为电能的原电池,由甲图可知,M是负极,N是正极,电解质溶液为酸性溶液,负极上失电子发生氧化反应,正极上得电子发生还原反应,在铁上镀铜,则铁为阴极应与负极相连,铜为阳极应与正极相连,根据得失电子守恒计算,据此分析解答.
解答 解:根据题给信息知,该装置是将化学能转化为电能的原电池,由甲图可知,M是负极,N是正极,电解质溶液为酸性溶液,负极上失电子发生氧化反应,正极上得电子发生还原反应,
A.铁上镀铜,则铁为阴极应与负极相连,铜为阳极应与正极Y相连,A错误;
B.M是负极,N是正极,质子透过离子交换膜由左M极移向右N极,故B错误;
C.若有机废水中含有葡萄糖,葡萄糖属于燃料,在负极M上失电子发生氧化反应,电极反应式为:(C6H10O5)n+7nH2O-24ne-═6nCO2↑+24nH+,故C正确;
D、当N电极消耗0.25mol氧气时,则转移0.25×4=1mol电子,所以铁电极增重0.5mol×64g/mol=32g,故D错误.
故选C.
点评 本题考查了原电池原理以及电镀原理,明确原电池正负极上得失电子、电解质溶液中阴阳离子移动方向即可解答,难度中等,侧重于考查学生的分析能力和计算能力.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
2.一种香豆素的衍生物结构如图所示,关于该有机物说法正确的是( )


| A. | 该有机物分子式为 C10H10O4 | |
| B. | 1mol该有机物与 H2发生加成时最多消耗H2 5 mol | |
| C. | 1mol该有机物与足量溴水反应时最多消耗Br23 mol | |
| D. | 1mol该有机物与 NaOH 溶液反应是最多消耗NaOH 3 mol |
20.化学与社会、生产、生活紧切相关.下列说法正确的是( )
| A. | 聚乙烯食品袋耐高温加热 | |
| B. | 石英玻璃仪器耐酸碱腐蚀 | |
| C. | 羊毛织物可用强碱性洗涤剂清洗 | |
| D. | 把铅加入锡中制造焊锡的目的是降低熔点 |
7.NA代表阿伏伽德罗常数的值,下列说法不正确的是( )
| A. | 过氧化钠与水反应生成2.24 L O2时转移的电子数为0.2NA | |
| B. | 1 L 14 mol/L硝酸与足量铜反应生成气体分子数小于7NA | |
| C. | 1 L1 mol/L NaHS溶液中H2S、HS-和S2-粒子数之和为NA | |
| D. | 1 mol OH-的电子总数比1 mol-OH的电子总数多NA |
17.含氮的化合物广泛存在于自然界,是一类非常重要的化合物.回答下列有关问题:
(1)在一定条件下:2N2(g)+6H2O(g)=4NH3(g)+3O2(g).已知该反应的相关的化学键键能数据如下:
则该反应的△H=+1268kJ/mol.
(2)电厂烟气脱氮的主要反应
I:4NH3(g)+6NO(g)═5N2(g)+6H2O(g)△H<0,副反应
II:2NH3(g)+8NO(g)═5N2O(g)+3H2O(g)△H>0.
①反应I的化学平衡常数的表达式为K=$\frac{{c}^{6}({H}_{2}O){c}^{5}({N}_{2})}{{c}^{6}(NO){c}^{4}(N{H}_{3})}$.
②对于在2L密闭容器中进行的反应I,在一定条件下n(NH3) 和n(N2) 随时间变化的关系如图1所示:
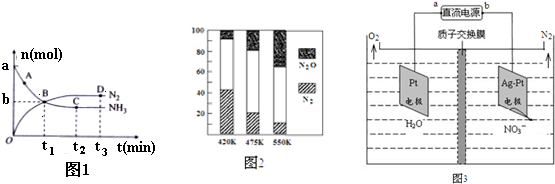
用NH3表示从开始到t1时刻的化学反应速率为$\frac{a-b}{2{t}_{1}}$ (用a、b、t表示)mol/(L•min),图中表示已达平衡的点为CD.
③电厂烟气脱氮的平衡体系的混合气体中N2和N2O含量与温度的关系如图2所示,在温度420~550K时,平衡混合气体中N2O含量随温度的变化规律是随温度升高,N2的含量降低,造成这种变化规律的原因是主反应为放热反应,升温使主反应的平衡左移或者副反应为吸热反应,升温使副反应的平衡右移,降低了NH3和NO浓度,使主反应的平衡左移.
(3)电化学降解法可治理水中硝酸盐的污染.电化学降解NO3-的原理如图3所示,电源正极为a(填“a”或“b”),阴极电极反应式为2NO3-+10e-+12H+=N2+6H2O.
(1)在一定条件下:2N2(g)+6H2O(g)=4NH3(g)+3O2(g).已知该反应的相关的化学键键能数据如下:
| 化学键 | N≡N | H-O | N-H | O=O |
| E/(kJ/mol) | 946 | 463 | 391 | 496 |
(2)电厂烟气脱氮的主要反应
I:4NH3(g)+6NO(g)═5N2(g)+6H2O(g)△H<0,副反应
II:2NH3(g)+8NO(g)═5N2O(g)+3H2O(g)△H>0.
①反应I的化学平衡常数的表达式为K=$\frac{{c}^{6}({H}_{2}O){c}^{5}({N}_{2})}{{c}^{6}(NO){c}^{4}(N{H}_{3})}$.
②对于在2L密闭容器中进行的反应I,在一定条件下n(NH3) 和n(N2) 随时间变化的关系如图1所示:

用NH3表示从开始到t1时刻的化学反应速率为$\frac{a-b}{2{t}_{1}}$ (用a、b、t表示)mol/(L•min),图中表示已达平衡的点为CD.
③电厂烟气脱氮的平衡体系的混合气体中N2和N2O含量与温度的关系如图2所示,在温度420~550K时,平衡混合气体中N2O含量随温度的变化规律是随温度升高,N2的含量降低,造成这种变化规律的原因是主反应为放热反应,升温使主反应的平衡左移或者副反应为吸热反应,升温使副反应的平衡右移,降低了NH3和NO浓度,使主反应的平衡左移.
(3)电化学降解法可治理水中硝酸盐的污染.电化学降解NO3-的原理如图3所示,电源正极为a(填“a”或“b”),阴极电极反应式为2NO3-+10e-+12H+=N2+6H2O.
9. 使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).
使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).
Ⅰ.实验步骤:
(1)配制100mL待测白醋溶液.量取10.00mL食用白醋,注入烧杯中用水稀释后转移到100mL容量瓶(填仪器名称)中定容,摇匀即得.
(2)取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴酚酞作指示剂.
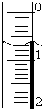
(3)读取盛装0.1000mol/L NaOH 溶液的碱式滴定管(填仪器名称)的初始读数.如果液面位置如右图所示,则此时的读数为0.70mL.
(4)滴定.当溶液由无色恰好变为红色,并在半分钟内不褪色时,停止滴定,并记录NaOH溶液的终读数.重复滴定3次.
Ⅱ.实验记录
Ⅲ.数据处理与讨论:
(1)经计算,市售白醋总酸量=4.5g/100mL
(2)在本实验滴定过程中,下列操作会使实验结果偏大是ab(填写序号)
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管尖嘴在滴定前无气泡,滴定后有气泡
c.锥形瓶中加入待测溶液后,再加少水
d.锥形瓶在滴定时剧烈摇动,有少液体溅出.
 使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).
使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).Ⅰ.实验步骤:
(1)配制100mL待测白醋溶液.量取10.00mL食用白醋,注入烧杯中用水稀释后转移到100mL容量瓶(填仪器名称)中定容,摇匀即得.
(2)取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴酚酞作指示剂.
(3)读取盛装0.1000mol/L NaOH 溶液的碱式滴定管(填仪器名称)的初始读数.如果液面位置如右图所示,则此时的读数为0.70mL.
(4)滴定.当溶液由无色恰好变为红色,并在半分钟内不褪色时,停止滴定,并记录NaOH溶液的终读数.重复滴定3次.
Ⅱ.实验记录
| 滴定次数 实验数据(mL) | 1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
(1)经计算,市售白醋总酸量=4.5g/100mL
(2)在本实验滴定过程中,下列操作会使实验结果偏大是ab(填写序号)
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管尖嘴在滴定前无气泡,滴定后有气泡
c.锥形瓶中加入待测溶液后,再加少水
d.锥形瓶在滴定时剧烈摇动,有少液体溅出.
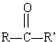 $→_{H+}^{HCN}$
$→_{H+}^{HCN}$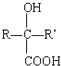 R或R′可以是烃基或氢原子
R或R′可以是烃基或氢原子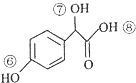 的说法正确的是AD.
的说法正确的是AD. .
.
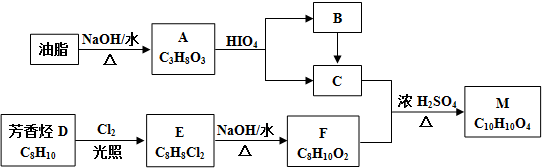
 $\stackrel{HIO_{4}}{→}$
$\stackrel{HIO_{4}}{→}$  +
+
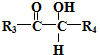 $\stackrel{HIO_{4}}{→}$R3COOH+
$\stackrel{HIO_{4}}{→}$R3COOH+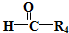
 .
.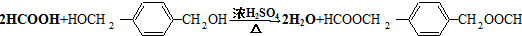 .
.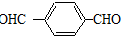
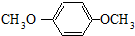

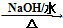 HOCH2CH2OH $\stackrel{HIO_{4}}{→}$HCHO
HOCH2CH2OH $\stackrel{HIO_{4}}{→}$HCHO 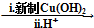 HCOOH
HCOOH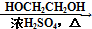 HCOOCH2CH2OOCH.
HCOOCH2CH2OOCH.