题目内容
为验证卤素单质氧化性的相对强弱,某小组用如图所示装置进行试验(夹持仪器已略去,气密性已检验).
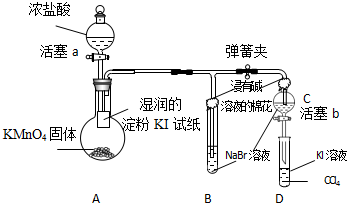
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸.
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹.
Ⅲ.当B中溶液由黄色变为棕色时,关闭活塞a.
Ⅳ.打开活塞b,将少量C中溶液滴入D中,然后关闭活塞b,…
(1)已知2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,该反应常用于实验室常温下制氯气.请用双线桥法标出此反应中电子转移的方向与数目,若该反应中生成标准状况下的氯气体积共0.112L,则转移的电子数目为 .
(2)验证氯气的氧化性强于碘的实验现象是 .
(3)B中溶液发生反应的化学方程式是 .
(4)为验证溴的氧化性强于碘,过程Ⅳ还需补充的操作为 .可观察到的现象是 .
(5)D中溶液发生反应的化学方程式是 .

实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸.
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹.
Ⅲ.当B中溶液由黄色变为棕色时,关闭活塞a.
Ⅳ.打开活塞b,将少量C中溶液滴入D中,然后关闭活塞b,…
(1)已知2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,该反应常用于实验室常温下制氯气.请用双线桥法标出此反应中电子转移的方向与数目,若该反应中生成标准状况下的氯气体积共0.112L,则转移的电子数目为
(2)验证氯气的氧化性强于碘的实验现象是
(3)B中溶液发生反应的化学方程式是
(4)为验证溴的氧化性强于碘,过程Ⅳ还需补充的操作为
(5)D中溶液发生反应的化学方程式是
考点:性质实验方案的设计
专题:实验设计题
分析:(1)反应中锰元素全部被还原,锰元素化合价由+7价降低为+2价,氯元素化合价由HCl中的-1升高为氯气中的0价,反应电子转移的数目为10e-;
(2)氯气氧化性强于单质碘,碘遇淀粉变蓝色;
(3)氯气的氧化性强于溴,将氯气通入NaBr溶液中会有单质溴生成,发生反应的离子方程式为:Cl2+2Br-═Br2+2Cl-;
(4)如CCl4层溶液变为紫红色,则说明有碘生成;
(5)D中溶液发生反应的化学方程式为溴单质与碘化钾反应生成溴化钾与碘单质.
(2)氯气氧化性强于单质碘,碘遇淀粉变蓝色;
(3)氯气的氧化性强于溴,将氯气通入NaBr溶液中会有单质溴生成,发生反应的离子方程式为:Cl2+2Br-═Br2+2Cl-;
(4)如CCl4层溶液变为紫红色,则说明有碘生成;
(5)D中溶液发生反应的化学方程式为溴单质与碘化钾反应生成溴化钾与碘单质.
解答:
解:(1)反应2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O中,Mn元素的化合价由+7降低为+2,KMnO4为氧化剂,得到的电子为2×(7-2)e-=10e-,Cl元素的化合价由-1升高为0,HCl为还原剂,失去的电子为5×2×(1-0)e-=10e-,双线桥标出反应中电子的转移方向和数目为 ;生成标准状况下的氯气体积共0.112L,即
;生成标准状况下的氯气体积共0.112L,即
=0.005mol,则转移的电子数目为0.005mol×2×6.02×1023=6.02×1021;
故答案为: ;6.02×1021;
;6.02×1021;
(2)淀粉变蓝色,说明有单质碘生成,也说明氯气氧化性强于单质碘,故答案为:湿润的淀粉KI试纸变蓝;
(3)氯气的氧化性强于溴,将氯气通入NaBr溶液中会有单质溴生成,发生反应的化学方程式为:Cl2+2NaBr=2NaCl+Br2故答案为:Cl2+2NaBr=2NaCl+Br2;
(4)为验证溴的氧化性强于碘,应将C中生成的溴加入到盛有KI溶液的D中,如发生氧化还原反应,则静至后CCl4层溶液变为紫红色,故答案为:打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D震荡;下层CCl4层溶液变为紫红色;
(5)D中溶液发生反应的化学方程式为溴单质与碘化钾反应生成溴化钾与碘单质,反应方程式为:Br2+2KI=2KBr+I2,故答案为:Br2+2KI=2KBr+I2.
 ;生成标准状况下的氯气体积共0.112L,即
;生成标准状况下的氯气体积共0.112L,即| 0.112 |
| 22.4 |
故答案为:
 ;6.02×1021;
;6.02×1021;(2)淀粉变蓝色,说明有单质碘生成,也说明氯气氧化性强于单质碘,故答案为:湿润的淀粉KI试纸变蓝;
(3)氯气的氧化性强于溴,将氯气通入NaBr溶液中会有单质溴生成,发生反应的化学方程式为:Cl2+2NaBr=2NaCl+Br2故答案为:Cl2+2NaBr=2NaCl+Br2;
(4)为验证溴的氧化性强于碘,应将C中生成的溴加入到盛有KI溶液的D中,如发生氧化还原反应,则静至后CCl4层溶液变为紫红色,故答案为:打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D震荡;下层CCl4层溶液变为紫红色;
(5)D中溶液发生反应的化学方程式为溴单质与碘化钾反应生成溴化钾与碘单质,反应方程式为:Br2+2KI=2KBr+I2,故答案为:Br2+2KI=2KBr+I2.
点评:本题为探究题和实验设计题,用以比较卤素单质的氧化性强弱,注意本题中要排除干扰因素的存在.

练习册系列答案
相关题目
下列化学工业有关设备、原料、反应条件配套的是( )
| A、接触法制硫酸:氧化炉、硫铁矿、V2O5、400℃-500℃ |
| B、联合制碱法制纯碱:吸氨塔、碳酸塔、食盐、二氧化碳、氨、30℃-35℃的氨化饱和食盐水吸收二氧化碳 |
| C、合成氨:沸腾炉、焦炭、铁触媒、500℃ |
| D、氨氧化法制硝酸:合成塔、空气、铂铑合金、800℃ |
下列化学方程式或离子方程式中,正确的是( )
A、用浓硫酸与4-溴-1-丁醇加热发生消去反应:BrCH2CH2CH2OH
| |||
B、水杨酸( )中加入NaHCO3溶液: )中加入NaHCO3溶液: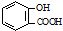 +2HCO3→ +2HCO3→ +2CO2↑+2H2O +2CO2↑+2H2O | |||
| C、在氢氧化钡溶液中滴加硫酸氢钾溶液至pH=7:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |||
| D、用侯氏制碱法制得NaHCO3:Na++NH3+CO2+H2O=NaHCO3↓+NH4+ |
 随着能源与环境问题越来越被人们关注,碳一化学(C1化学)成为研究的热点.“碳一化学”即以单质碳及CO、CO2、CH4、CH3OH等含一个碳原子的物质为原料合成工业产品的化学与工艺.
随着能源与环境问题越来越被人们关注,碳一化学(C1化学)成为研究的热点.“碳一化学”即以单质碳及CO、CO2、CH4、CH3OH等含一个碳原子的物质为原料合成工业产品的化学与工艺.
 在一定条件下可水解为
在一定条件下可水解为 和R2-NH2,则F在强酸和长时间加热条件下发生水解反应的化学方程式是
和R2-NH2,则F在强酸和长时间加热条件下发生水解反应的化学方程式是


