题目内容
19.某气体在标准状况下的密度为1.25g•L-1,则 28g该气体所含有的分子数为6.02×1023或NA分析 根据ρ=$\frac{M}{{V}_{m}}$计算出该气体的摩尔质量,然后根据n=$\frac{m}{M}$、N=nNA计算出28g该气体所含有的分子数.
解答 解:某气体在标准状况下的密度为1.25g•L-1,该气体的摩尔质量为:M=ρVm=1.25g•L-1×22.4L/mol=28g/mol,
28g该气体的物质的量为:$\frac{28g}{28g/mol}$=1mol,所以28g该气体所含有的分子数为6.02×1023或NA,
故答案为:6.02×1023或NA.
点评 本题考查了物质的量的计算,题目难度不大,明确标准状况下密度与摩尔质量之间的关系为解答关键,注意熟练掌握物质的量与其它物理量之间的转化关系,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
9.近年,我国科学家首次拍摄到水分子团簇图象,模型如图.下列说法正确的是( )


| A. | H、O两种元素只能组成水 | B. | 团簇中的水分子不再运动 | ||
| C. | 水蒸气冷凝成水,分子间隔减小 | D. | 可燃冰和冰都是由水分子构成的 |
10.将100gNaHCO3和Na2CO3•10H2O的混合物溶于水得2L溶液,其中[Na+]=0.5mol/L,若将100g该混合物在500℃左右条件下充分灼烧,求质量不再变化时剩余固体质量为多少.
7.下列由相关实验现象所推出的结论正确的是( )
| A. | Cl2、SO2均能使品红溶液褪色,说明二者使有色物质褪色原理相同 | |
| B. | 向溶液中滴加酸化的Ba(NO3)2溶液出现白色沉淀,说明该溶液中一定有SO42- | |
| C. | Fe与稀HNO3、稀H2SO4反应均有气泡产生,说明Fe与两种酸均发生置换反应 | |
| D. | 分别充满HCl、NH3的烧瓶倒置于水中后液面均迅速上升,说明二者均易溶于水 |
14.下列实验装置设计正确,且能达到目的是( )
| A. | 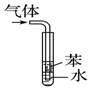 吸收氨气,并防止倒吸 | B. | 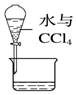 分离水和CCl4 | ||
| C. | 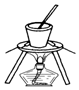 从食盐水中提取NaCl | D. | 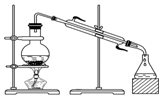 石油的分馏 |
8.设NA表示阿伏加德罗常数,下列叙述不正确的是( )
| A. | 阿伏加德罗常数NA是0.012 kg 12C中所含的原子数 | |
| B. | 1 g氢气所含氢原子数目为NA | |
| C. | 标准状况下,22.4 L 乙醇所含的分子数目为NA | |
| D. | 1 L 1 mol•L-1 NaOH溶液中所含有的Na+离子数目为NA |
9.化学与人类生产、生活密切相关,下列有关说法正确的是( )
| A. | 浓硫酸具有吸水性,可作食品干燥剂 | |
| B. | 夏天雷雨过后感觉到空气清新是因为产生了少量NO2 | |
| C. | 缤纷绚丽的烟花中添加了含钾、钠、钙、铜等金属元素的化合物 | |
| D. | 明矾可以使海水淡化,从而解决“淡水供应危机” |
 (一种常用的化妆品防霉剂),其生产过程如图(反应条件未全部注明)所示:
(一种常用的化妆品防霉剂),其生产过程如图(反应条件未全部注明)所示:
 ;
;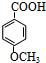 +C2H5OH$?_{△}^{浓硫酸}$
+C2H5OH$?_{△}^{浓硫酸}$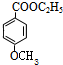 +H2O;
+H2O;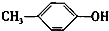 +CH3I→
+CH3I→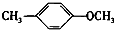 +HI.
+HI.