题目内容
18.A、B、C、D、E、F、G是原子序数依次增大的短周期元素,其中A与E、D与G同主族,且D与G核内质子数之和是A与E核内质子数之和的2倍,A与B、C、D可分别形成10电子分子,E、F、G元素最高价氧化物对应水化物之间可相互发生反应,请回答下列问题(1)E元素的符号:Na;F在元素周期表中的位置是第三周期第ⅢA族.
(2)Zn与稀硫酸反应需加入少量硫酸铜溶液反应速率会大大加快,其原理是金属锌与硫酸铜反应生成铜,形成锌铜原电池加快产生氢气的速率.
(3)E在D2中燃烧生成化合物X中阴阳离子个数比为1:2;X中的阴离子电子式为
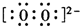 .
.
分析 A、B、C、D、E、F、G是原子序数依次增大的短周期元素,E、F、G元素最高价氧化物对应水化物之间可相互发生反应,为氢氧化铝、强酸、强碱之间的反应,故其中一种为氢氧化铝,短周期内,强碱为氢氧化钠,原子序数E、F、G是原子序数依次增大,故E为Na元素,F为Al元素,G为S元素或Cl元素;A与B、C、D可分别形成10电子分子,A与E同主族,则A为H元素;D与G同主族,且D与G核内质子数之和是A与E核内质子数之和的2倍,则D、G的原子序数中为2×(1+11)=24,故D为O元素,G为S元素;B、C、D原子序数依次增大,都能与氢元素形成10电子分子,则B为碳元素,C为N元素,据此解答.
解答 解:A、B、C、D、E、F、G是原子序数依次增大的短周期元素,E、F、G元素最高价氧化物对应水化物之间可相互发生反应,为氢氧化铝、强酸、强碱之间的反应,故其中一种为氢氧化铝,短周期内,强碱为氢氧化钠,原子序数E、F、G是原子序数依次增大,故E为Na元素,F为Al元素,G为S元素或Cl元素;A与B、C、D可分别形成10电子分子,A与E同主族,则A为H元素;D与G同主族,且D与G核内质子数之和是A与E核内质子数之和的2倍,则D、G的原子序数中为2×(1+11)=24,故D为O元素,G为S元素;B、C、D原子序数依次增大,都能与氢元素形成10电子分子,则B为碳元素,C为N元素.
(1)由上述分析可知,E为Na元素,F为Al元素,处于周期表中第三周期第ⅢA族,
故答案为:Na;第三周期第ⅢA族;
(2)金属锌与硫酸铜反应生成铜,形成锌铜原电池加快产生氢气的速率,
故答案为:金属锌与硫酸铜反应生成铜,形成锌铜原电池加快产生氢气的速率;
(3)Na在O2中燃烧生成化合物X为Na2O2,阴阳离子个数比为1:2,阴离子电子式是: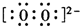 ,
,
故答案为:1:2;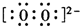 .
.
点评 本题考查结构性质位置关系应用,推断元素是解题的关键,突破口为E、F、G元素最高价氧化物对应水化物之间可相互发生反应及A与B、C、D可分别形成10电子分子.

| A. | 玻璃 | B. | 塑料 | C. | 合成橡胶 | D. | 合成纤维 |
| A. | F-的结构示意图: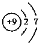 | |
| B. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}$O | |
| C. | 氮气的电子式: | |
| D. | 乙烯的结构简式:CH2CH2 |
| A. | 1molNa与乙醇完全反应,失去2NA电子 | |
| B. | 常温常压下,8gCH4含有5NA个电子 | |
| C. | 6.0g冰醋酸与4.6g乙醇反应生成乙酸乙酯的分子数为0.1 NA | |
| D. | 标准状况下,22.4L苯含有NA个C6H6分子 |
【实验原理】2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
| 实验编号 | 实验温度 | 试管中所加试剂及其用量/mL | 溶液褪至无色所需时间/min | |||
| 0.6mol/L H2C2O4溶液 | H2O | 3mol/L 稀H2SO4溶液 | 0.05mol/L KMnO4溶液 | |||
| ① | 25 | 3.0 | V1 | 2.0 | 3.0 | 1.5 |
| ② | 25 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
| ③ | 50 | 2.0 | V2 | 2.0 | 3.0 | 1.0 |
(2)实验①、②探究的是浓度对化学反应速率的影响,根据表中的实验数据,可以得到的结论是其他条件不变时,增大(减小)反应物浓度,加快(减慢)化学反应速率.
(3)探究温度对化学反应速率的影响,应选择②③(填实验编号).
(4)利用实验1中的数据,计算用KMnO4表示的化学反应速率为1.0×10-2mol/(L•min).
(5)该小组同学根据经验绘制了n(Mn2+)随时间变化的趋势如图1所示,但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的实际趋势如图2所示.
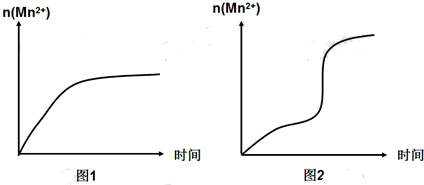
该小组同学根据图2所示信息提出了新的假设,并设计以下实验方案继续进行实验探究.
| 实验编号 | 实验温度/℃ | 试管中所加试剂及其用量 | 再向试管中加 入某种固体 | 溶液褪至无色所需时间/min | |||
| 0.6mol/L H2C 2O4溶液 | H2O | 3mol/L 稀H2SO4溶液 | 0.05mol/L KMnO4溶液 | ||||
| ④ | 25 | 2.0 | 3.0 | 2.0 | 3.0 | MnSO4 | t |
②若该小组同学提出的假设成立,应观察到加入MnSO4固体后,KMnO4溶液比实验②更快褪色现象.

| A. | ①装置可用于蒸干氯化铝溶液制AlCl3 | |
| B. | ②装置可用于分离CCl4萃取碘水后已分层的有机层和水层 | |
| C. | ③装置可用于收集NH3或HCl气体,并防止倒吸 | |
| D. | ④装置盐桥中的K+自右向左移动 |
| A. | 该反应为置换反应 | B. | 该晶体为分子晶体 | ||
| C. | 该物质是一种新的化合物 | D. | 该物质的相对分子质量是2400 |
①FeCl2②H2SO4③NH4NO3④HCl ⑤FeCl3.
| A. | 只有①②③ | B. | 只有④⑤ | C. | 只有①③④ | D. | 全部 |
| A. | 加热氢氧化钠晶体使之熔化 | B. | 电解水使之分解 | ||
| C. | 碘单质受热升华 | D. | 加热二氧化硅晶体使之熔化 |