题目内容
13.甲烷和乙烷混合气体完全燃烧时,消耗相同状况下氧气的体积是混合气体的2.8倍,则甲烷与乙烷的体积比是( )| A. | 8:7 | B. | 5:7 | C. | 7:8 | D. | 7:5 |
分析 反应的方程式分别为:CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O,C2H6+$\frac{7}{2}$O2$\stackrel{点燃}{→}$2CO2+3H2O,设出甲烷和乙烷的体积,然后根据方程式及消耗氧气的体积列式计算.
解答 解:设混合气体中甲烷的体积为x,乙烷的体积为y,
CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O,
1 2
x 2x
C2H6+$\frac{7}{2}$O2$\stackrel{点燃}{→}$2CO2+3H2O
1 3.5
y 3.5y
根据消耗相同状况下氧气的体积是混合气体的2.8倍可知:$\frac{x+y}{2x+3.5y}$=$\frac{1}{2.8}$,整理可得:x:y=8:7,
故选A.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应原理为解答关键,试题侧重基础知识的考查,培养了学生的分析能力及化学计算能力.

练习册系列答案
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案
相关题目
4.(1)已知A和B元素原子的第一至第四电离能如下表所示:
据表中数据,你推断A元素原子最外层有3个电子,已知A和B是同周期元素,可以推出A的金属性<B的金属性(填“>”“<”或“=”).
(2)紫外光的光子所具有的能量约为399kJ•mol-1.根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因紫外光具有的能量比蛋白质分子中重要的化学键C-C、C-N和C-S的键能都大,紫外光的能量足以使这些化学键断裂,从而破坏蛋白质分子.组成蛋白质的最简单的氨基酸中的碳原子杂化类型是sp2和sp3.
(3)实验证明:KCl、MgO、CaO三种晶体的结构与NaCl晶体结构相似,则这三种离子晶体(不包括NaCl)熔点从高到低的顺序是:MgO>CaO>KCl.
(4)金属阳离子含有的未成对电子越多,则磁性越大,磁记录性能越好.离子型氧化物V2O5和CrO2中,不适合作录音带磁粉原料的是V2O5.
(5)某配合物的分子结构如图所示,其分子内不含有AC(填序号).
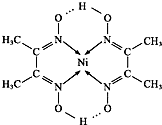
A.离子键 B.极性键 C.金属键 D.配位键E.氢键 F.非极性键
(6)科学家设计反应:CO2+4H2→CH4+2H2O以减小空气中的CO2.若有1mol CH4生成,则反应中有8molσ键生成.
| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1 817 | 2 745 | 11 578 |
| B | 738 | 1 451 | 7 733 | 10 540 |
(2)紫外光的光子所具有的能量约为399kJ•mol-1.根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因紫外光具有的能量比蛋白质分子中重要的化学键C-C、C-N和C-S的键能都大,紫外光的能量足以使这些化学键断裂,从而破坏蛋白质分子.组成蛋白质的最简单的氨基酸中的碳原子杂化类型是sp2和sp3.
| 共价键 | C-C | C-N | C-S |
| 键能/kJ•mol-1 | 347 | 305 | 259 |
(4)金属阳离子含有的未成对电子越多,则磁性越大,磁记录性能越好.离子型氧化物V2O5和CrO2中,不适合作录音带磁粉原料的是V2O5.
(5)某配合物的分子结构如图所示,其分子内不含有AC(填序号).

A.离子键 B.极性键 C.金属键 D.配位键E.氢键 F.非极性键
(6)科学家设计反应:CO2+4H2→CH4+2H2O以减小空气中的CO2.若有1mol CH4生成,则反应中有8molσ键生成.
1.已知反应3O2(g)=2O3(g)的△H<0、△S<0,对此反应叙述正确的是( )
| A. | 该反应在任何情况下均能自发进行 | |
| B. | 该反应在任何情况下均不能自发进行 | |
| C. | 该反应在一定条件下能自发进行 | |
| D. | 条件不足,无法判断 |
8.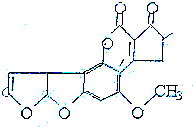 黄曲霉素AFTB(见图)是污染粮食的真菌霉素,人类的特殊基因在黄曲霉素作用下会发生突变,并有引发肝癌的可能性.关于黄曲霉素的说法正确的是( )
黄曲霉素AFTB(见图)是污染粮食的真菌霉素,人类的特殊基因在黄曲霉素作用下会发生突变,并有引发肝癌的可能性.关于黄曲霉素的说法正确的是( )
 黄曲霉素AFTB(见图)是污染粮食的真菌霉素,人类的特殊基因在黄曲霉素作用下会发生突变,并有引发肝癌的可能性.关于黄曲霉素的说法正确的是( )
黄曲霉素AFTB(见图)是污染粮食的真菌霉素,人类的特殊基因在黄曲霉素作用下会发生突变,并有引发肝癌的可能性.关于黄曲霉素的说法正确的是( )| A. | 该化合物的分子式为C16H12O6 | |
| B. | 该化合物水解可生成醇类化合物 | |
| C. | 跟1mol该化合物反应的H2和NaOH的最大值分别是6mol和2mol | |
| D. | 该化合物所有原子可能在同一平面上 |
18.下列说法不正确的是( )
| A. | 某芳香烃的分子式为C10H14,不能使溴水因反应而褪色,苯环上只有一个取代基,符合条件的烃有4种 | |
| B. | 按照系统命名法,有机物 的命名为2,2,4,4,5-五甲基-3,3-二乙基己烷 的命名为2,2,4,4,5-五甲基-3,3-二乙基己烷 | |
| C. | 甲烷、甲醛、甲酸甲脂都不存在同分异构体 | |
| D. | 某有机物含有C、H、O、N四种元素,其球棍模型为 该有机物能发生取代反应 该有机物能发生取代反应 |
5.某化合物的结构式 (键线式)及球棍模型如图1:该有机分子的核磁共振氢谱图如图2(单位是ppm).下列关于该有机物的叙述正确的是( )
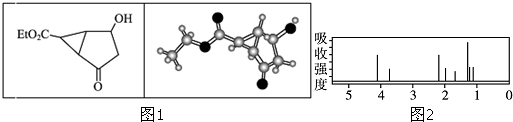

| A. | 该有机物不同化学环境的氢原子有8种 | |
| B. | 该有机物属于芳香族化合物 | |
| C. | 键线式中的Et代表的基团为-CH3 | |
| D. | 利用质谱法不能确定该有机物的相对分子质量 |
11.食醋(主要成分CH3COOH )、纯碱(Na2CO3 )和小苏打(NaHCO3 )均为家庭厨房中常用的物质.已知:
请回答下列问题:
(1)一定温度下,向0.1mol/LCH3COOH 溶液中加入少量CH3COONa 晶体时,下列说法正确的是ad(填代号).
a.溶液的pH增大 b. CH3COOH的电离程度增大
c.溶液的导电能力减弱 d.溶液中c(OH-)•c(H+)不变
(2)25℃时,向CH3COOH溶液中加入一定量的NaHCO3,所得混合液的pH=6,则混合液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=18.
(3)常温下,将20mL 0.1mol•L-1 CH3COOH溶液和20mL0.1mol•L-1HNO2溶液分别与20mL 0.1 mol•L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图1所示,则表示CH3COOH溶液的曲线是②(填写序号);反应结束后所得两溶液中,c(CH3COO-)<c(NO2-)(填“>”、“<”或“=”);
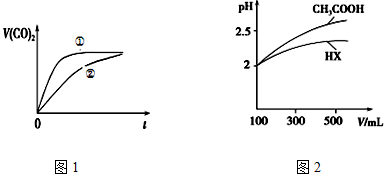
(4)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如上图2所示,则HX的电离平衡常数小于(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数.
(5)25℃时,将等体积、等物质的量浓度的醋酸与氨水混合后,溶液的pH=7,则NH3•H2O的电离常数Kb=1.8×10-5.
| 弱酸 | CH3COOH | H | HNO |
| 电离常数(25℃) | K=1.8×10-5 | K=4.×10-7 K=5.6×10-11 | K=5.0×10-4 |
(1)一定温度下,向0.1mol/LCH3COOH 溶液中加入少量CH3COONa 晶体时,下列说法正确的是ad(填代号).
a.溶液的pH增大 b. CH3COOH的电离程度增大
c.溶液的导电能力减弱 d.溶液中c(OH-)•c(H+)不变
(2)25℃时,向CH3COOH溶液中加入一定量的NaHCO3,所得混合液的pH=6,则混合液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=18.
(3)常温下,将20mL 0.1mol•L-1 CH3COOH溶液和20mL0.1mol•L-1HNO2溶液分别与20mL 0.1 mol•L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图1所示,则表示CH3COOH溶液的曲线是②(填写序号);反应结束后所得两溶液中,c(CH3COO-)<c(NO2-)(填“>”、“<”或“=”);

(4)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如上图2所示,则HX的电离平衡常数小于(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数.
(5)25℃时,将等体积、等物质的量浓度的醋酸与氨水混合后,溶液的pH=7,则NH3•H2O的电离常数Kb=1.8×10-5.
12.下列说法正确的是( )
| A. | 氯水氨水食盐水都能导电,所以Cl2、NH3和氯化钠都是电解质 | |
| B. | 向醋酸溶液中加入少量醋酸溶液,原醋酸电离平衡一定向正向移动 | |
| C. | 升高温度能促进弱电解质的电离 | |
| D. | 强电解质溶液的导电能力一定比弱电解质溶液的导电能力强 |
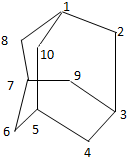 有的油田开采的石油中溶有一种碳氢化合物-金刚烷.
有的油田开采的石油中溶有一种碳氢化合物-金刚烷.