题目内容
某同学用12mol?L-1的浓盐酸配制100mL 1.0mol?L-1的稀盐酸,并进行有关实验.请回答下列问题:
(1)需要量取浓盐酸 mL.
(2)配制过程中,不需要的仪器(填写代号) .
A.药匙 B.胶头滴管 C.玻璃棒 D.烧杯 E.天平
除上述仪器外,完成实验还缺少的仪器是 .
(3)若实验遇下列情况,溶液的浓度偏高的是
A、加水定容时越过刻度线 B、定容时俯视刻度线
C、容量瓶内壁附有水珠而未干燥处理 D、溶解后没有冷却直接转移并定容
(4)取所配制的稀盐酸50mL,与一定质量的镁充分反应,镁全部溶解后,生成的气体在标准状况下的体积为0.448L,则参加反应的镁的质量为 g,设反应后溶液的体积仍为50mL,则反应后溶液中Cl-的物质的量浓度为 mol?L-1.
(1)需要量取浓盐酸
(2)配制过程中,不需要的仪器(填写代号)
A.药匙 B.胶头滴管 C.玻璃棒 D.烧杯 E.天平
除上述仪器外,完成实验还缺少的仪器是
(3)若实验遇下列情况,溶液的浓度偏高的是
A、加水定容时越过刻度线 B、定容时俯视刻度线
C、容量瓶内壁附有水珠而未干燥处理 D、溶解后没有冷却直接转移并定容
(4)取所配制的稀盐酸50mL,与一定质量的镁充分反应,镁全部溶解后,生成的气体在标准状况下的体积为0.448L,则参加反应的镁的质量为
考点:配制一定物质的量浓度的溶液
专题:实验题
分析:(1)根据溶液稀释前后溶质的物质的量相等计算需要浓盐酸的体积;
(2)根据配制100mL 1.0mol?L-1的稀盐酸的步骤选用仪器,然后判断还缺少的仪器;
(3)根据c=
可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量n和溶液的体积V引起的,误差分析时,关键要看配制过程中引起n和V怎样的变化:若n比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若n比理论值大,或V比理论值小时,都会使所配溶液浓度偏大;
(4)根据氢气和镁之间的关系式计算镁的质量,根据氯离子不参与反应可知氯离子的物质的量浓度不变.
(2)根据配制100mL 1.0mol?L-1的稀盐酸的步骤选用仪器,然后判断还缺少的仪器;
(3)根据c=
| n |
| V |
(4)根据氢气和镁之间的关系式计算镁的质量,根据氯离子不参与反应可知氯离子的物质的量浓度不变.
解答:
解:(1)设浓盐酸的体积为V,则12mol×V=1mol/L×0.1L,V=0.0083L=8.3mL,故答案为:8.3;
(2)配制100mL 1.0mol?L-1的稀盐酸的步骤为:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀等,需要使用的仪器有:10mL量筒、烧杯、玻璃棒、100mL容量瓶、胶头滴管,所以不需要的仪器为药匙和天平,还缺少的仪器为:100mL容量瓶、量筒,
故答案为:AE;100mL容量瓶、10mL量筒;
(3)A、加水定容时越过刻度线,导致配制的溶液体积偏大,配制的溶液浓度偏低,故A错误;
B、定容时俯视刻度线,导致加入的蒸馏水体积偏小,配制的溶液体积偏小,溶液的浓度偏高,故B正确;
C、容量瓶内壁附有水珠而未干燥处理,对溶质的物质的量及最终溶液体积都没影响影响,所以不影响配制结果,故C错误;
D、溶解后没有冷却直接转移并定容,热的溶液体积偏大,冷却后溶液体积变小,导致配制的溶液体积偏小,溶液的浓度偏高,故D正确;
故答案为:BD;
(4)盐酸和镁反应的方程式为:Mg+2HCl=MgCl2+H2↑,设参加反应的镁的质量为x,
Mg+2HCl=MgCl2+H2↑,
24g 22.4L
x 0.448L
x=
=0.48g,
由于反应过程中氯离子不参加反应,所以氯离子浓度不变,c(Cl-)=c(HCl)=1.0mol/L,
故答案为:0.48;1.0.
(2)配制100mL 1.0mol?L-1的稀盐酸的步骤为:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀等,需要使用的仪器有:10mL量筒、烧杯、玻璃棒、100mL容量瓶、胶头滴管,所以不需要的仪器为药匙和天平,还缺少的仪器为:100mL容量瓶、量筒,
故答案为:AE;100mL容量瓶、10mL量筒;
(3)A、加水定容时越过刻度线,导致配制的溶液体积偏大,配制的溶液浓度偏低,故A错误;
B、定容时俯视刻度线,导致加入的蒸馏水体积偏小,配制的溶液体积偏小,溶液的浓度偏高,故B正确;
C、容量瓶内壁附有水珠而未干燥处理,对溶质的物质的量及最终溶液体积都没影响影响,所以不影响配制结果,故C错误;
D、溶解后没有冷却直接转移并定容,热的溶液体积偏大,冷却后溶液体积变小,导致配制的溶液体积偏小,溶液的浓度偏高,故D正确;
故答案为:BD;
(4)盐酸和镁反应的方程式为:Mg+2HCl=MgCl2+H2↑,设参加反应的镁的质量为x,
Mg+2HCl=MgCl2+H2↑,
24g 22.4L
x 0.448L
x=
| 0.448L×24g |
| 22.4L |
由于反应过程中氯离子不参加反应,所以氯离子浓度不变,c(Cl-)=c(HCl)=1.0mol/L,
故答案为:0.48;1.0.
点评:本题考查了配制一定物质的量浓度的溶液的方法,题目难度中等,试题基础性强,注重灵活性,侧重对学生能力的培养和解题方法的指导和训练,该题的难点在于误差分析,注意明确误差分析的方法.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列叙述正确的是( )
| A、将FeCl3溶液加热蒸干得到FeCl3固体 |
| B、向Fe(NO3)2溶液中加少量盐酸,无明显现象 |
| C、向氢氧化镁悬浊液中滴加FeCl3溶液,无明显现象 |
| D、向 FeSO4溶液中滴加NaOH溶液,先出现白色沉淀,最终沉淀转化成红褐色 |
在乙酸乙酯、乙醇、乙酸水溶液共存的化学平衡体系中加入含重氢的水,经过足够长的时间后,可以发现,除水外体系中含重氢的化合物是( )
| A、只有乙醇 |
| B、乙酸、乙醇 |
| C、只有乙酸乙酯 |
| D、乙酸乙酯、乙醇、乙酸 |
下列各组数据中,前者刚好是后者两倍的是( )
| A、2 mol水的摩尔质量和1 mol水的摩尔质量 |
| B、200 mL 1 mol/L氯化钙溶液中c(Cl-)和100 mL 2 mol/L氯化钾溶液中c(Cl-) |
| C、64 g二氧化硫中氧原子数和标准状况下22.4 L一氧化碳中氧原子数 |
| D、20%NaOH溶液中NaOH的物质的量浓度和10%NaOH溶液中NaOH的物质的量浓度 |

 四种元素A、B、C、D位于元素周期表的前四周期,已知它们的核电荷数依次增加,且核电荷数之和为50;A元素原子的核外只有一个电子;B元素原子的L层p轨道中有2个电子;C元素原子与B元素原子的价层电子数相同;D原子的最外层电子数为1,其d轨道中的电子数与K层电子数之比为5:1.
四种元素A、B、C、D位于元素周期表的前四周期,已知它们的核电荷数依次增加,且核电荷数之和为50;A元素原子的核外只有一个电子;B元素原子的L层p轨道中有2个电子;C元素原子与B元素原子的价层电子数相同;D原子的最外层电子数为1,其d轨道中的电子数与K层电子数之比为5:1. 燃料电池是一种连续的将燃料和氧化剂的化学能直接转化为电能的化学电池.氢气、烃、肼、甲醇等液体或气体,均可以作燃料电池的燃料.请回答下列问题:
燃料电池是一种连续的将燃料和氧化剂的化学能直接转化为电能的化学电池.氢气、烃、肼、甲醇等液体或气体,均可以作燃料电池的燃料.请回答下列问题: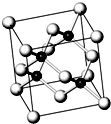 砷化镓属于第三代半导体,它能直接将电能转变为光能,砷化镓灯泡寿命是普通灯泡的100倍,而耗能只有其10%,推广砷化镓等发光二极管(LED)照明,是节能减排的有效举措.已知砷化镓的晶胞结构如图.试回答下列问题:
砷化镓属于第三代半导体,它能直接将电能转变为光能,砷化镓灯泡寿命是普通灯泡的100倍,而耗能只有其10%,推广砷化镓等发光二极管(LED)照明,是节能减排的有效举措.已知砷化镓的晶胞结构如图.试回答下列问题: