题目内容
【题目】实验室以工业钴渣为原料制取CoSO4溶液和ZnSO4·7H2O晶体,其实验流程如下:
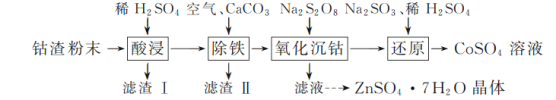
已知:①“酸浸”所得溶液中主要含CoSO4、ZnSO4,另含少量FeSO4、NiSO4。②金属活动性:Ni介于Fe、Cu之间。③下表是相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度1 mol·L-1计算,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-):
金属离子 | 开始沉淀的pH | 完全沉淀的pH |
Co2+ | 7.6 | 9.4 |
Zn2+ | 5.9 | 8.9 |
(1)“酸浸”时所加稀硫酸不宜过量太多的原因是________。
(2)“除铁”时,向溶液中持续鼓入空气的作用是________。
(3)流程中需将滤渣Ⅰ、滤渣Ⅱ的洗涤液与“除铁”后所得滤液合并,目的是________。
(4)写出“还原”过程中Na2SO3、稀H2SO4与Co(OH)3反应的离子方程式:________。
(5)实验所得CoSO4溶液可用于制备CoCO3,制备时CoSO4饱和溶液与Na2CO3饱和溶液的混合方式为________。
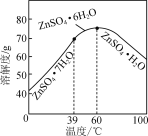
(6)请结合如图硫酸锌晶体的溶解度曲线,设计从“氧化沉钴”后的滤液(含ZnSO4、Na2SO4、NiSO4等)中获取ZnSO4·7H2O的实验方案:取适量滤液,____________________________,过滤,用少量冰水洗涤,低温干燥得ZnSO4·7H2O晶体。(实验中须使用的试剂有:Zn粉、1.0 mol·L-1 NaOH、1.0 mol·L-1 H2SO4)
【答案】避免除铁时消耗过多的CaCO3 将Fe2+氧化,搅拌溶液,加快反应速率 为提高Co、Zn的回收率 SO![]() +2Co(OH)3+4H+=2Co2++SO
+2Co(OH)3+4H+=2Co2++SO![]() +5H2O 将Na2CO3饱和溶液缓慢滴加到CoSO4饱和溶液中,并不断搅拌 向其中加入过量的Zn粉后过滤,向所得滤液中滴加1.0 mol·L-1 NaOH,控制pH约为10(8.9~11)使Zn2+完全沉淀,所得沉淀洗净后用1.0 mol·L-1 H2SO4完全溶解,将所得溶液蒸发浓缩至有晶膜出现,冷却至0 ℃(39 ℃以下)结晶
+5H2O 将Na2CO3饱和溶液缓慢滴加到CoSO4饱和溶液中,并不断搅拌 向其中加入过量的Zn粉后过滤,向所得滤液中滴加1.0 mol·L-1 NaOH,控制pH约为10(8.9~11)使Zn2+完全沉淀,所得沉淀洗净后用1.0 mol·L-1 H2SO4完全溶解,将所得溶液蒸发浓缩至有晶膜出现,冷却至0 ℃(39 ℃以下)结晶
【解析】
钴渣中加稀硫酸将可溶于酸的物质转变成硫酸盐,难溶于硫酸的进入滤渣1,得到溶液中主要含CoSO4、ZnSO4,另含少量FeSO4、NiSO4,滤液中通入氧气亚铁离子氧化成三价铁离子,加碳酸钙中和硫酸调节pH值将铁沉淀除去,过滤后滤液中加Na2S2O8,氧化沉淀钴,过滤得钴的沉淀物加亚硫酸钠和稀硫酸还原的得到硫酸钴,滤液中主要是硫酸锌,除去杂质后经过蒸发浓缩、冷却结晶、过滤得到ZnSO4·7H2O晶体,据此分析解答。
(1)“酸浸”时所加稀硫酸不宜过量太多,因后续步骤中要加碳酸钙调节溶液pH值,硫酸过多会增加碳酸钙的用量,故答案为:避免除铁时消耗过多的CaCO3;
(2)因为原溶液中的铁是二价铁,二价铁直接沉淀时需要调控的pH较大且会使其他金属阳离子沉淀,因此以溶解度更小的氢氧化铁形式除铁更合理,需通入空气将亚铁离子氧化,同时持续鼓入空气可以起到搅拌溶液加快速率的作用,故答案为:将Fe2+氧化,搅拌溶液,加快反应速率;
(3)流程中需将滤渣Ⅰ、滤渣Ⅱ的洗涤液与“除铁”后所得滤液合并可以减少钴和锌的损失,提高两者的回收率,故答案为:为提高Co、Zn的回收率;
(4)还原”过程中Na2SO3、稀H2SO4与Co(OH)3反应产物为硫酸钴和硫酸钠,可得方程式为:SO![]() +2Co(OH)3+4H+=2Co2++SO
+2Co(OH)3+4H+=2Co2++SO![]() +5H2O,故答案为:SO
+5H2O,故答案为:SO![]() +2Co(OH)3+4H+=2Co2++SO
+2Co(OH)3+4H+=2Co2++SO![]() +5H2O;
+5H2O;
(5)实验所得CoSO4溶液可用于制备CoCO3,制备时CoSO4饱和溶液与Na2CO3饱和溶液的混合方式为将Na2CO3饱和溶液缓慢滴加到CoSO4饱和溶液中,并不断搅拌,故答案为:将Na2CO3饱和溶液缓慢滴加到CoSO4饱和溶液中,并不断搅拌;
(6)氧化沉钴”后的滤液(含ZnSO4、Na2SO4、NiSO4等)中有杂质直接结晶得不到纯净的晶体,因此要先加足量的锌粉置换出镍,之后加氢氧化钠调节溶液pH将锌转变成沉淀后过滤的到氢氧化锌固体,再将固体溶于硫酸,蒸发浓缩再冷却至39 ℃以下结晶,具体操作:向其中加入过量的Zn粉后过滤,向所得滤液中滴加1.0 mol·L-1 NaOH,控制pH约为10(8.9~11)使Zn2+完全沉淀,所得沉淀洗净后用1.0 mol·L-1 H2SO4完全溶解,将所得溶液蒸发浓缩至有晶膜出现,冷却至0 ℃(39 ℃以下)结晶,故答案为:向其中加入过量的Zn粉后过滤,向所得滤液中滴加1.0 mol·L-1 NaOH,控制pH约为10(8.9~11)使Zn2+完全沉淀,所得沉淀洗净后用1.0 mol·L-1 H2SO4完全溶解,将所得溶液蒸发浓缩至有晶膜出现,冷却至0 ℃(39 ℃以下)结晶。

 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案