题目内容
9.用NA表示阿伏加德罗常数,下列说法中,正确的是( )| A. | 56g氮气所含有的原子数目为NA | |
| B. | 标准状况下,22.4L苯中含有NA个水分子化学反应中 | |
| C. | 0.5mol金属镁变成镁离子时失去电子的数目为NA | |
| D. | 标准状况下,22.4L氦气所含的原子数为2NA |
分析 A.质量转化为物质的量结合1个氮气分子含有2个氮原子解答;
B.气体摩尔 体积使用对象为气体;
C.镁失去电子生成二价镁离子;
D.氦气为单原子分子.
解答 解:A.56g氮气物质的量$\frac{56g}{28g/mol}$=2mol,含有氮原子4mol,含有的原子数目为4NA,故A错误;
B.标况下,苯为液体,不能使用气体摩尔体积,故B错误;
C.0.5mol金属镁变成镁离子时失去电子的数目为0.5mol×2×NA=NA,故C正确;
D.标准状况下,22.4L氦气物质的量为1mol,所含的原子数为NA,故D错误;
故选:C.
点评 本题考查了阿伏伽德罗常数的应用,掌握以物质的量为核心的相关计算公式是解题关键,注意气体摩尔体积使用对象和条件,注意氦气为单原子分子,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
20.实验设计是科学研究的重要步骤.下列叙述正确的是( )
| A. | Fe2O3固体可以用FeSO4溶液在蒸发皿中加热蒸干获得 | |
| B. | 可用碳酸氢铵溶液鉴别稀盐酸、氢氧化钠溶液、氯化铝溶液 | |
| C. | 用稀硝酸检验氢气还原氧化铜所生成的红色固体中含有氧化亚铜 | |
| D. | 测定相同条件下盐酸和磷酸溶液的pH,证明非金属性:Cl>P |
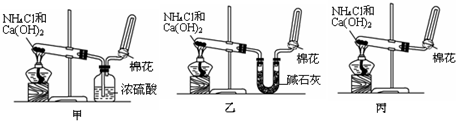
17.实验室用加热固体氯化铵和氢氧化钙的混合物制取氨,反应的化学方程式为:Ca(OH)2+2NH4Cl═CaCl2+2NH3↑+2H2O.所制得气体中常含有少量杂质气体,为了得到纯净的氨气并加以检验,请在下列装置或试剂中,根据要求作出适当选择,并将编号字母填入表中的空格处.
(1)装置:
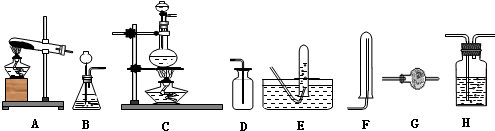
(2)试剂:a.NaOH溶液 b.澄清石灰水 c.浓硫酸 d.饱和NaHCO3溶液
e.碱石灰 f.品红溶液 g.湿润的红色石蕊试纸
(1)装置:

(2)试剂:a.NaOH溶液 b.澄清石灰水 c.浓硫酸 d.饱和NaHCO3溶液
e.碱石灰 f.品红溶液 g.湿润的红色石蕊试纸
| 制取气体 | 杂质气体 | 制取气体的发生装置 | 除去杂质气体的净化装置 | 收集装置 | 净化装置内 所用试剂 | 检验制得气体所用试剂 |
| NH3 | H2O(g) |
14.能源分类相关图如图所示,下列四组选项中,全部符合图中阴影部分的能源是( )
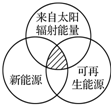

| A. | 沼气、煤炭、石油 | B. | 海洋能、地热能、核能 | ||
| C. | 天然气、水能、生物能 | D. | 风能、太阳能、潮汐能 |
1.常温下,柠檬水溶液的pH是4,苹果醋溶液的pH是5,则柠檬水溶液与苹果醋溶液的c(OH-)之比为( )
| A. | 10:1 | B. | 1:10 | C. | 2:1 | D. | 4:5 |
18.将钠和锌各0.3mol分别放入 100mL 1mol/L盐酸中,同温同压下产生气体的体积比是( )
| A. | 1:3 | B. | 3:1 | C. | 1:1 | D. | 3:2 |
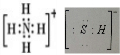 ,写出再生反应的化学方程式:2NH4HS+O2$\frac{\underline{\;一定条件\;}}{\;}$2NH3•H2O+2S;NH3的沸点高于H2S,是因为NH3分子之间存在着一种叫分子间作用的作用力.
,写出再生反应的化学方程式:2NH4HS+O2$\frac{\underline{\;一定条件\;}}{\;}$2NH3•H2O+2S;NH3的沸点高于H2S,是因为NH3分子之间存在着一种叫分子间作用的作用力.