题目内容
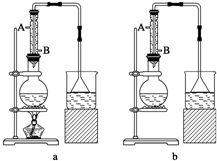
1.下列仪器,能加热但应该垫石棉网使用的是( )| A. | 蒸发皿 | B. | 锥形瓶 | C. | 坩埚 | D. | 表面皿 |
分析 根据常见的用于加热的仪器进行分析解答,可直接加热的仪器有:试管、燃烧匙、蒸发皿、坩埚等;需要垫石棉网的是:烧杯、烧瓶、锥形瓶等;据此进行分析判断.
解答 解:蒸发皿、坩埚都可直接加热,表面皿不能用来加热,锥形瓶需垫上石棉网才可进行加热.
故选B.
点评 本题考查用于加热的仪器,题目难度不大,了解常见仪器的名称、用途、注意事项等是解答本题的关键.

练习册系列答案
相关题目
9.设NA为阿伏伽德罗常数的值,下列叙述不正确的是( )
| A. | 1molNa与O2完全反应生成Na2O2和Na2O的混合物,转移电子的总数为NA | |
| B. | 室温下,31.0g白磷中含有的共价键数目为1.5NA | |
| C. | 常温常压下,17g甲基(-14CH3)含有的电子数为9NA | |
| D. | 常温下,1.0L pH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA |
12.金属钛(Ti)被誉为21世纪金属,具有良好的生物相容性,它兼具铁的高强度和铝的低密度.其单质和化合物具有广泛的应用价值.氮化钛(Ti3N4)为金黄色晶体,由于具有令人满意的仿金效果,越来越多地成为黄金的代替品.以TiCl4为原料,经过一系列反应可以制得Ti3N4和纳米TiO2(如图1).

图中的M是短周期金属元素,M的部分电离能如表:请回答下列问题:
(1)Ti的基态原子外围电子排布式为4d25s2;
(2)M是Mg(填元素符号),该金属晶体的堆积模型为六方最密堆积,配位数为12;
(3)纳米TiO2是一种应用广泛的催化剂,纳米TiO2催化的一个实例如图2所示.化合物甲的分子中采取sp2方式杂化的碳原子有7个,化合物乙中采取sp3方式杂化的原子对应的元素的电负性由大到小的顺序为O>N>C;
(4)有一种氮化钛晶体的晶胞与NaCl晶胞相似,如图3所示,该晶胞中N、Ti之间的最近距离为a pm,则该氮化钛的密度为$\frac{4×62}{{N}_{A}×(2a×1{0}^{-10})^{3}}$ g•cm-3(NA为阿伏加德罗常数的值,只列计算式).该晶体中与N原子距离相等且最近的N原子有12个;
(5)科学家通过X-射线探明KCl、MgO、CaO、TiN的晶体与NaCl的晶体结构相似.且知三种离子晶体的晶格能数据如下:
KCl、CaO、TiN三种离子晶体熔点由高到低的顺序为TiN>CaO>KCl.

图中的M是短周期金属元素,M的部分电离能如表:请回答下列问题:
| I1 | I2 | I3 | I4 | I5 | |
| 电离能/kJ•mol-1 | 738 | 1451 | 7733 | 1054 0 | 13630 |
(2)M是Mg(填元素符号),该金属晶体的堆积模型为六方最密堆积,配位数为12;
(3)纳米TiO2是一种应用广泛的催化剂,纳米TiO2催化的一个实例如图2所示.化合物甲的分子中采取sp2方式杂化的碳原子有7个,化合物乙中采取sp3方式杂化的原子对应的元素的电负性由大到小的顺序为O>N>C;
(4)有一种氮化钛晶体的晶胞与NaCl晶胞相似,如图3所示,该晶胞中N、Ti之间的最近距离为a pm,则该氮化钛的密度为$\frac{4×62}{{N}_{A}×(2a×1{0}^{-10})^{3}}$ g•cm-3(NA为阿伏加德罗常数的值,只列计算式).该晶体中与N原子距离相等且最近的N原子有12个;
(5)科学家通过X-射线探明KCl、MgO、CaO、TiN的晶体与NaCl的晶体结构相似.且知三种离子晶体的晶格能数据如下:
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
9.某化学兴趣小组欲研究一种镁铝合金,以下是部分实验.请完成填空.
[实验一]从镁铝合金片上剪下一小块,先称重,然后投到盛有10mL 10mol•L-1NaOH溶液(足量)的锥形瓶里.
(1)从反应开始至反应结束,依次可观察到的现象有:①切口断面处先产生气泡,反应由慢到快;②小块合金在溶液中上下翻腾;③溶液升温;④反应后,溶液中残留黑色固体.
(2)开始时产生气泡速率慢,其主要原因(除温度、电化学因素外)是合金表面有氧化膜.
(3)欲利用此反应测定合金中铝的含量,请仿照方法①写出另一种不同方法所需数据.
[实验二]向实验一的锥形瓶里滴加1mol•L-1HCl,使镁、铝两种元素恰好只以氯化物的形式存在.
[实验三]请设计合理实验检验实验二所得溶液中的Mg2+、Al3+.
限选实验用品与试剂:烧杯、试管、滴管、1mol•L-1NaOH溶液、1mol•L-1HCl溶液、蒸馏水.
根据你设计的实验方案,叙述实验操作、预期现象和结论.(可填满、可不填满)
[实验四]粉末状试样A是由MgO和Fe2O3组成的混合物.取适量A进行铝热反应,产物中有单质B生成.
产物中的单质B是Fe(填化学式).
[实验一]从镁铝合金片上剪下一小块,先称重,然后投到盛有10mL 10mol•L-1NaOH溶液(足量)的锥形瓶里.
(1)从反应开始至反应结束,依次可观察到的现象有:①切口断面处先产生气泡,反应由慢到快;②小块合金在溶液中上下翻腾;③溶液升温;④反应后,溶液中残留黑色固体.
(2)开始时产生气泡速率慢,其主要原因(除温度、电化学因素外)是合金表面有氧化膜.
(3)欲利用此反应测定合金中铝的含量,请仿照方法①写出另一种不同方法所需数据.
| 方法 | 需测定的数据 |
| ① | 测定产生的H2的体积 |
| ② | “测定残留固体镁的质量”或“测定反应消耗或剩余的NaOH的量”或“测定生成的NaAlO2的量” |
[实验三]请设计合理实验检验实验二所得溶液中的Mg2+、Al3+.
限选实验用品与试剂:烧杯、试管、滴管、1mol•L-1NaOH溶液、1mol•L-1HCl溶液、蒸馏水.
根据你设计的实验方案,叙述实验操作、预期现象和结论.(可填满、可不填满)
| 实验操作 | 预期现象和结论 |
| 步骤1: | |
| 步骤2: | |
| … |
产物中的单质B是Fe(填化学式).
16.把Cu粉放入稀硫酸,加热后并无明显现象,当加入一种盐的晶体后,可看到溶液呈蓝色,同时有气体逸出,此盐晶体是( )
| A. | FeCl3 | B. | Na2SO4 | C. | Na2CO3 | D. | NaNO3 |
6.下列说法错误的是( )
| A. | 纯铁的抗腐蚀能力比生铁强 | |
| B. | 可用酒精洗涤附着在试管内壁上的固态硫 | |
| C. | 用惰性电极电解熔融NaCl可获得金属钠 | |
| D. | 二氧化硅能与NaOH溶液反应,所以盛放碱液的试剂瓶不能用磨口玻璃塞 |
13.锂电池是新一代的高能电池,它以质轻、能高而受到普遍重视.目前已经研制成功了多种锂电池.某种锂电池的总反应可表示为:Li+MnO2═LiMnO2,若该电池提供5C电荷量(其他损耗忽略不计),则消耗的正极材料的质量约为(式量Li:7,MnO2:87,电子电荷量取1.60×10-19 C)( )
| A. | 3.5×10-3 g | B. | 7×10-4 g | C. | 4.52×10-3 g | D. | 4.52×10-2 g |
 ,
,
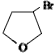 ,D
,D ,E
,E .
.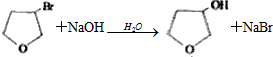 .
.