题目内容
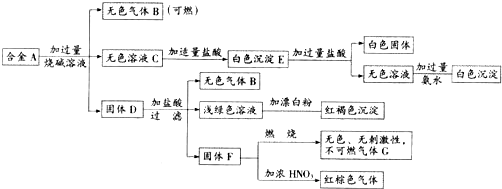
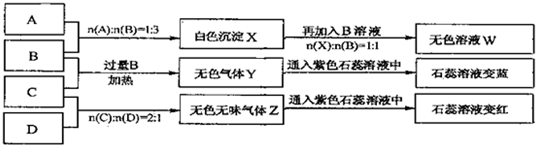
现有四瓶丢失标签的NaOH、Na2CO3、AlCl3、NH4HSO4溶液,为鉴别四瓶溶液,将四瓶溶液编号为A、B、C、D进行实验.实验过程和记录如下图所示(无关物质已经略去):
请回答:
(1)Y、Z的化学式分别为:Y ;Z X与B反应的离子方程式为 .
(2)D溶液pH (填“大于”、“小于”或“等于”)7,原因是(用离子方程式表示) .
(3)等物质的量浓度的A、B、C、D溶液pH由大到小的顺序是 .(用化学式表示)
(4)请写出C与过量B反应(加热)的离子方程式 .
(5)写出C、D按2:1反应的离子方程式 .

请回答:
(1)Y、Z的化学式分别为:Y
(2)D溶液pH
(3)等物质的量浓度的A、B、C、D溶液pH由大到小的顺序是
(4)请写出C与过量B反应(加热)的离子方程式
(5)写出C、D按2:1反应的离子方程式
考点:无机物的推断
专题:推断题
分析:由A、B反应生成白色沉淀,再加过量B沉淀溶解生成无色溶液,则B为NaOH,A为AlCl3;B与C反应生成气体使石蕊变蓝,则气体为氨气,所以C为NH4HSO4;C、D反应生成的无色无味的气体为二氧化碳,D为Na2CO3,然后结合物质的性质及化学用语来解答.
解答:
解:由A、B反应生成白色沉淀,再加过量B沉淀溶解生成无色溶液,则B为NaOH,A为AlCl3;B与C反应生成气体使石蕊变蓝,则气体为氨气,所以C为NH4HSO4;C、D反应生成的无色无味的气体为二氧化碳,D为Na2CO3,
(1)由以上分析可知Y为NH3,Z为CO2,X为氢氧化铝,X与B的离子反应为Al(OH)3+OH-=AlO2-+2H2O,故答案为:NH3;CO2;Al(OH)3+OH-=AlO2-+2H2O;
(2)D为Na2CO3,水解显碱性,pH大于7,水解离子反应为CO32-+H2O?HCO3-+OH-,故答案为:大于;CO32-+H2O?HCO3-+OH-;
(3)A、B、C、D四种溶液,其中NaOH和Na2CO3呈碱性的pH>7,而且NaOH碱性>Na2CO3,AlCl3和NH4HSO4呈酸性,pH<7,酸性:NH4HSO4>AlCl3,所以等物质的量浓度A、B、C、D的pH由大到小的顺序是:NaOH>Na2CO3>AlCl3>NH4HSO4,故答案为:NaOH>Na2CO3>AlCl3>NH4HSO4;
(4)C与过量B反应(加热)的离子方程式为NH4++H++2OH-
NH3↑+2H2O,故答案为:NH4++H++2OH-
NH3↑+2H2O;
(5)C为NH4HSO4,D为Na2CO3,C、D按2:1反应的离子方程式为CO32-+2H+═H2O+CO2↑,故答案为:CO32-+2H+═H2O+CO2↑.
(1)由以上分析可知Y为NH3,Z为CO2,X为氢氧化铝,X与B的离子反应为Al(OH)3+OH-=AlO2-+2H2O,故答案为:NH3;CO2;Al(OH)3+OH-=AlO2-+2H2O;
(2)D为Na2CO3,水解显碱性,pH大于7,水解离子反应为CO32-+H2O?HCO3-+OH-,故答案为:大于;CO32-+H2O?HCO3-+OH-;
(3)A、B、C、D四种溶液,其中NaOH和Na2CO3呈碱性的pH>7,而且NaOH碱性>Na2CO3,AlCl3和NH4HSO4呈酸性,pH<7,酸性:NH4HSO4>AlCl3,所以等物质的量浓度A、B、C、D的pH由大到小的顺序是:NaOH>Na2CO3>AlCl3>NH4HSO4,故答案为:NaOH>Na2CO3>AlCl3>NH4HSO4;
(4)C与过量B反应(加热)的离子方程式为NH4++H++2OH-
| ||
| ||
(5)C为NH4HSO4,D为Na2CO3,C、D按2:1反应的离子方程式为CO32-+2H+═H2O+CO2↑,故答案为:CO32-+2H+═H2O+CO2↑.
点评:本题考查无机物的推断,利用物质反应的现象推断各物质为解答的关键,涉及盐类水解与反应的先后顺序、离子浓度大小的比较等,综合性较强,注重高考高频考点的考查,题目难度中等.

练习册系列答案
相关题目
设NA为阿伏加德罗常数,下列叙述正确的是( )
| A、24 g镁的原子最外层电子数为NA |
| B、1 L 0.1 mol?L-1硫酸溶液中H+数为0.1NA |
| C、1 mol甲烷分子所含质子数为10NA |
| D、标准状况下,22.4 L乙醇的分子数为NA |
为了区别五瓶无色溶液:HCl、AlCl3、Ba(NO3)2,NaCl、Na2CO3,四位同学都没用酒精灯,三位同学另用了试剂,一位同学没有另用任何试剂.其中操作步骤一定最少的是( )
| A、甲另用了酚酞试液 |
| B、乙另用了NaOH溶液 |
| C、丙另用了石蕊试液 |
| D、丁不另用任何试剂 |
已知铬的价电子排布式为3d54s1,电负性为1.66,I1=652.9KJ/mol,I2=aKJ/mol;锰的价电子排布式为3d54s2,电负性为1.59,I1=717.3KJ/mol,I2=bKJ/mol.下列说法不正确的是( )
| A、锰、铬都是d区元素 |
| B、锰的未成对电子数比铬的多 |
| C、a>b |
| D、a、b的值取决于铬锰的核外电子排布 |



 (尿素)氮原子上的氢原子可以像苯酚上的氢原子那样与甲醛发生加成反应,并缩聚成高分子.
(尿素)氮原子上的氢原子可以像苯酚上的氢原子那样与甲醛发生加成反应,并缩聚成高分子. →B的反应类型是
→B的反应类型是