��Ŀ����
20����ɫ����ۺ���������SPFS����һ����Ҫ�����߷�������������������ˮ����Ϊ��ҵ��������ˮ���������������Ҫ��Ӧ�ã�SPFS�ɱ�ʾ��Fex��OH��y��SO4��z•nH2O����ҵ�ϳ��õ�һ���Ʊ�����Ϊ��
��SPFS�Ķ������ָ���У��λ�������Ҫ������ָ��֮һ���λ��ȶ���Ϊ��
�λ���=n��OH-��/3n��Fe����100%��ʽ��n��OH-����n��Fe���ֱ��ʾ����ۺ���������OH-��Fe�����ʵ�����
��1�����Խ�����NaClO3����FeSO4•7H2O�����ӷ���ʽ6Fe2++ClO3-+6H+�T6Fe3++Cl-+3H2O��
��2��ȡ7.507gij����ۺ��������ܽ���ˮ�������м��������BaCl2��Һ��������ȫ�������ˡ�ϴ�ӡ�����ð�ɫ����10.485g����������Һ�м���NH3•H2O��������ҺpH=6�������ˡ�ϴ�ӡ������Fe2O3����2.80g���Լ���ù���ۺ����������λ��ȣ�
��3��������ù���ۺ���������Ʒ�Ļ�ѧʽ��
���� ��1����������Ӿ��������ԣ��������Ӿ��л�ԭ�ԣ��ݴ�����д����ʽ��
��2��������Ԫ�ء���������ӵ��غ��ϵ��ȷ������������֪��Ϣ�����λ��ȣ��λ���=n��OH-��/3n��Fe����100%��ʽ��n��OH-����n��Fe���ֱ��ʾ����ۺ���������OH-��Fe�����ʵ�����
��3������ԭ���غ�������غ�������õ���Ʒ�Ļ�ѧʽ��
��� �⣺��1����������Ӿ��������ԣ��������Ӿ��л�ԭ�ԣ����߷�����������ԭ��ӦΪ��
6Fe2++ClO3-+6H+�T6Fe3++Cl-+3H2O��
�ʴ�Ϊ��6Fe2++ClO3-+6H+�T6Fe3++Cl-+3H2O��
��2�����������������������Լ���ã�n��Fe��=$\frac{2.8g}{160g/mol}$��2=0.035mol��ȡ7.507gij����ۺ��������ܽ���ˮ�������м��������BaCl2��Һ��������ȫ�������ˡ�ϴ�ӡ�����ð�ɫ����10.485g����Ϊ���ᱵ������������10.485g��
����n��SO42-��=$\frac{10.485g}{233g/mol}$=0.045mol������n��OH-��=3��n��Fe��-2��n��SO42-��=3��0.035-2��0.045=0.015mol�������=$\frac{n��O{H}^{-}��}{3n��Fe��}$��100%=$\frac{0.015mol}{3��0.035mol}$��100%=14.29%��
�𣺸ù���ۺ����������λ�����14.29%��
��3�����������غ���Եó�Fex��OH��y��SO4��z•nH2O��ˮ����n��H2O��=��7.507g-0.035mol��56g•mol-1-0.045mol��96 g•mol-1-0.015mol��17 g•mol-1����$\frac{1}{18g��mol}$=0.054mol����֪����n��Fe��=0.035mol��n��OH-��=0.015mol��n��SO42-��=0.045mol����ѧʽ�и�Ԫ�ص����ʵ���֮�ȵ��������ֵ�ȣ�����ѧʽ��Fe35��OH��15��SO4��45•54H2O��
�𣺸ù���ۺ���������Ʒ�Ļ�ѧʽΪFe35��OH��15��SO4��45•54H2O��
���� ������һ������֪ʶ����Ŀ������ѧ�������ͽ��������������ۺ��Խ�ǿ����Ŀ�ѶȽϴ�

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�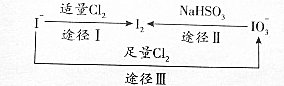 ���ڵؿ�����Ҫ��NaIO3����ʽ���ڣ��ں�ˮ����Ҫ��I-����ʽ���ڣ���������֮������ͼת����ϵ��������ͼת����ϵ�Ʋ�����˵������ȷ���ǣ�������
���ڵؿ�����Ҫ��NaIO3����ʽ���ڣ��ں�ˮ����Ҫ��I-����ʽ���ڣ���������֮������ͼת����ϵ��������ͼת����ϵ�Ʋ�����˵������ȷ���ǣ�������| A�� | ����KI-������ֽ��ʳ����ӵ������Ƿ��е� | |
| B�� | �ڵ�ˮ��ͨ��Cl2��������Ӧ�Ļ�ѧ����Ϊ5Cl2+I2+6H2O=2HIO3+10HCI | |
| C�� | ��ͼ��֪�����Ե�ǿ��˳��ΪCl2��I2��IO3 | |
| D�� | ;�����У�������1moICl2����Ӧ��ת�Ƶĵ���Ϊ2moI |
| A�� | H2C=CH-CN | B�� | H2C=CH-CH=CH2 | C�� |  | D�� |  |
| A�� | 10 ��b-2a��mol•L-1 | B�� | 5��b-2a��mol•L-1 | C�� | 2��b-a��mol•L-1 | D�� | 10��2a-b��mol•L-1 |
| A�� | ����������ϡ�����У�Al+2H+�TA13++H2�� | |
| B�� | ����Cl2ͨ��KI��Һ�У�Cl2+2I-�T2C1-+I2 | |
| C�� | ������ˮ��Һ��ͨ������CO2��2CH3COO-+CO2+H2O�T2CH3COOH+CO32- | |
| D�� | ̼��п����ϡ�����У�CO32-+2H+�TH2O+CO2�� |
| A�� | ԭ������Ϊ34 | |
| B�� | ����������ˮ����ķ���ʽΪ��H2SeO4 | |
| C�� | Se�ķǽ����Ա�Brǿ | |
| D�� | ��̬�⻯����ȶ��Ա����������� |
