题目内容
19.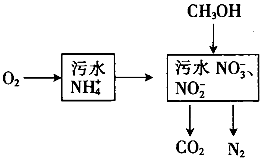 处理生活污水中的NH4+,过程如下:
处理生活污水中的NH4+,过程如下:(1)空气将NH4+转变为NO3-或NO2-,溶液pH减小(填“增大”、“减小”或“不变”).
(2)根据较新的研究表明,将只含NO2-的污水与含NH4+的污水按比例混合,直接转化为无毒气体,该气体为N2.此方法的优点是不消耗甲醇等还原剂,减少原材料.
(3)完全处理含1mol NH4+污水,则n(O2)与n(CH3OH)关系式为4n(O2)=3+6n(CH3OH)[以n(O2)与n(CH3OH)表示].
分析 (1)根据空气将NH4+转变为NO3-或NO2-的反应为:NH4++2O2=NO3-+2H++H2O,酸性增强;
(2)NO2-的污水与含NH4+的污水按比例混合,转化的无毒气体是氮气;
(3)根据得失电子守恒计算.
解答 解:(1)空气将NH4+转变为NO3-(或NO2-)的反应为:NH4++2O2=NO3-+2H++H2O,酸性增强,pH减小;
故答案为:减小;
(2)NO2-的污水与含NH4+的污水按比例混合,转化的无毒气体是氮气,此方法的优点是不消耗甲醇等还原剂,减少原材料,
故答案为:N2;不消耗甲醇等还原剂,减少原材料;
(3)处理含1mol NH4+污水,整个过程铵根离子、甲醇是还原剂,只有氧气是氧化剂,氧气得到的电子为4n(O2)mol,1molNH4+失电子为3mol,甲醇失电子为6n(CH3OH),根据得失电子守恒可知:4n(O2)=3+6n(CH3OH),
故答案为:4 n(O2)=3+6n(CH3OH).
点评 本题考查氧化还原反应及计算,为高频考点,把握反应中元素的化合价变化、发生的反应、电子守恒为解答的关键,侧重分析与应用能力的考查,注意化学与生活的联系,题目难度不大.

练习册系列答案
相关题目
10.下列对图象的叙述正确的是( )
| A. |  对于反应:A2(g)+3B2(g)?2AB2(g),图①中的横轴x可以表示压强 | |
| B. |  如图表示其他条件相同时,甲、乙两份等质量锌粉分别与足量稀硫酸反应,甲中加入少量铜粉 | |
| C. |  如图可表示乙酸溶液中通入氨气至过量时溶液导电性的变化 | |
| D. |  据图,若除去0.1mol•L-1CuSO4溶液中的Fe3+,可向溶液中加入适量NaOH至pH约为7 |
7.25℃时,下列溶液中粒子的物质的量浓度关系正确的是( )
| A. | 向浓度为0.1mol•L-1的NaHCO3溶液中滴加少量盐酸后所得溶液中:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| B. | pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合所得溶液中:c(CH3COO-)+c(H+)>c(Na+)+c(OH-) | |
| C. | 0.1 mol•L-1CH3COOH溶液和0.1 mol•L-1CH3COONa溶液等体积混合:c(Na+)>c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) | |
| D. | 0.1 mol•L-1 NH4HSO4溶液中滴加0.1 mol•L-1 NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
14.能证明Fe(NO3)3中铁元素具有氧化性的实验事实是( )
| A. | 通人H2S,有黄色沉淀 | |
| B. | 加入铜粉,溶液变为蓝色 | |
| C. | 加人锌粉,溶液棕黄色逐渐消失 | |
| D. | 滴加NaHCO3溶液,有气体和红棕色沉淀生成 |
9.根据下列实验操作和现象所得到的结论正确的是( )
| A. | 向NaAlO2溶液中通入足量CO2,有白色沉淀产生,说明碳酸的酸性强于氢氧化铝 | |
| B. | 用铂丝蘸取某溶液进行焰色反应,火焰呈黄色,说明溶液中不含有K+ | |
| C. | 在KI淀粉溶液中滴入氯水变蓝,再通入SO2,蓝色褪去,说明SO2具有漂白性 | |
| D. | 向某FeCl2溶液中,加入Na2O2粉末出现红褐色沉淀,说明原FeCl2已氧化变质 |