题目内容
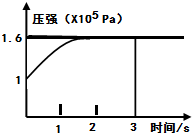 (2013?达州模拟)一定温度下,向体积为2L的恒容密闭容器中充入1mol PCl5(g),发生反应:
(2013?达州模拟)一定温度下,向体积为2L的恒容密闭容器中充入1mol PCl5(g),发生反应:PCl5(g)?PCl3(g)+Cl2(g)△H=+Q KJ/mol维持容器温度不变,测得容器内压强随反应时间的变化如图所示.下列说法正确的是( )
分析:A.恒温、恒容的密闭容器中,气体的物质的量之比等于压强之比,根据压强之间的关系式结合差量法计算生成的PCl3的物质的量,再根据V(PCl3)=
计算;
B.该反应是吸热反应;
C.平衡体系中再加入1mol的PCl5,重新到达平衡状态,可以等效为开始加入2mol的PCl5,体积增大为原来的2倍,达平衡(该平衡与原平衡等效)后再将体积压缩到原来大小,与原平衡相比,积压缩压强增大平衡状态,平衡向体积减小的方向移动,即向逆反应方向移动;
D.平衡常数只与温度有关,与物质的浓度无关.
| ||
| △t |
B.该反应是吸热反应;
C.平衡体系中再加入1mol的PCl5,重新到达平衡状态,可以等效为开始加入2mol的PCl5,体积增大为原来的2倍,达平衡(该平衡与原平衡等效)后再将体积压缩到原来大小,与原平衡相比,积压缩压强增大平衡状态,平衡向体积减小的方向移动,即向逆反应方向移动;
D.平衡常数只与温度有关,与物质的浓度无关.
解答:解:A.恒温、恒容的密闭容器中,气体的物质的量之比等于压强之比,则平衡时混合气体的物质的量为1.6mol,气体的物质的量增大(1.6-1)mol=0.6mol,设生成PCl3的物质的量为x,
PCl5(g)?PCl3(g)+Cl2(g) 气体增加的物质的量
1mol 1mol
x 0.6mol
x=
mol=0.6mol,
V(PCl3)=
=
=0.1mol/(L.s),时间单位是S不是min,故A错误;
B.该反应是吸热反应不是放热反应,当气体增加1mol时吸收的热量是QKJ,则气体增加0.6mol时吸收的热量是0.6QKJ,故B错误;
C.平衡体系中再加入1mol的PCl5,重新到达平衡状态,可以等效为开始加入2mol的PCl5,体积增大为原来的2倍,达平衡(该平衡与原平衡等效)后再将体积压缩到原来大小,与原平衡相比,压强增大,平衡向逆反应方向移动,则平衡浓度大于原来的两倍,故C正确;
D.温度不变,平衡常数不变,故D错误;
故选C.
PCl5(g)?PCl3(g)+Cl2(g) 气体增加的物质的量
1mol 1mol
x 0.6mol
x=
| 1×0.6 |
| 1 |
V(PCl3)=
| ||
| △t |
| ||
| 3s |
B.该反应是吸热反应不是放热反应,当气体增加1mol时吸收的热量是QKJ,则气体增加0.6mol时吸收的热量是0.6QKJ,故B错误;
C.平衡体系中再加入1mol的PCl5,重新到达平衡状态,可以等效为开始加入2mol的PCl5,体积增大为原来的2倍,达平衡(该平衡与原平衡等效)后再将体积压缩到原来大小,与原平衡相比,压强增大,平衡向逆反应方向移动,则平衡浓度大于原来的两倍,故C正确;
D.温度不变,平衡常数不变,故D错误;
故选C.
点评:本题考查化学平衡、等效平衡思想的利用,难度中等,注意C中等效平衡思想,把一个平衡的建立设计成多步进行,使问题简单化.

练习册系列答案
相关题目
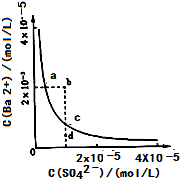 (2013?达州模拟)难溶物BaSO4在水中的溶解平衡可表示为:BaSO4(s)?Ba2+(aq)+SO42-(aq).其溶度积常数Ksp=C(Ba2+)?C(SO42-),某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )
(2013?达州模拟)难溶物BaSO4在水中的溶解平衡可表示为:BaSO4(s)?Ba2+(aq)+SO42-(aq).其溶度积常数Ksp=C(Ba2+)?C(SO42-),某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )