题目内容
(2013?达州模拟)常温下,下列溶液中各微粒浓度关系不正确的是( )
分析:A.阴离子水解程度大小关系是CH3COO-<HCO3-<C6H5O-,等pH的这三种盐溶液,阴离子水解程度越大的其溶液的浓度越小;
B.溶液呈中性,则C(OH-)=C(H+),根据电荷守恒判断铵根离子和硫酸根离子浓度关系;
C.先判断溶液中的溶质再根据物料守恒判断;
D.根据电荷守恒判断.
B.溶液呈中性,则C(OH-)=C(H+),根据电荷守恒判断铵根离子和硫酸根离子浓度关系;
C.先判断溶液中的溶质再根据物料守恒判断;
D.根据电荷守恒判断.
解答:解:A.阴离子水解程度大小关系是CH3COO-<HCO3-<C6H5O-,等pH的这三种盐溶液,盐浓度大小顺序是:①>③>②,所以C(Na+)大小关系:①>③>②,故A正确;
B.溶液呈中性,则C(OH-)=C(H+),溶液中存在电荷守恒C(NH4+)+C(H+)=2C(SO42-)+C(OH-),所以C(NH4+)=2C(SO42-),故B正确;
C.氢氧化钠的物质的量是0.1mol,n(CO2)=
mol=0.15mol,氢氧化钠和二氧化碳的物质的量之比是0.1mol:0.15mol=2:3,所以二氧化碳和氢氧化钠发生的反应为CO2+NaOH=NaHCO3,二氧化碳有剩余,溶液中的溶质是碳酸氢钠,根据物料守恒得C(Na+)=C(CO32-)+C(HCO3-)+C(H2CO3),故C错误;
D.溶液中存在电荷守恒C(Na+)+C(H+)+c(K+)=C(CH3COO-)+C(OH-)+C(NO3-),硝酸钾是强酸强碱盐,则c(K+)=C(NO3-),所以得C(Na+)+C(H+)=C(CH3COO-)+C(OH-),故D正确;
故选C.
B.溶液呈中性,则C(OH-)=C(H+),溶液中存在电荷守恒C(NH4+)+C(H+)=2C(SO42-)+C(OH-),所以C(NH4+)=2C(SO42-),故B正确;
C.氢氧化钠的物质的量是0.1mol,n(CO2)=
| 6.6 |
| 44 |
D.溶液中存在电荷守恒C(Na+)+C(H+)+c(K+)=C(CH3COO-)+C(OH-)+C(NO3-),硝酸钾是强酸强碱盐,则c(K+)=C(NO3-),所以得C(Na+)+C(H+)=C(CH3COO-)+C(OH-),故D正确;
故选C.
点评:本题考查离子浓度大小的比较,根据物料守恒和电荷守恒来分析解答,易错选项是C,明确溶液中的溶质是解该选项的关键,难度较大.

练习册系列答案
相关题目
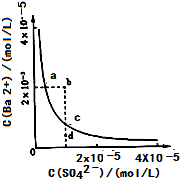 (2013?达州模拟)难溶物BaSO4在水中的溶解平衡可表示为:BaSO4(s)?Ba2+(aq)+SO42-(aq).其溶度积常数Ksp=C(Ba2+)?C(SO42-),某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )
(2013?达州模拟)难溶物BaSO4在水中的溶解平衡可表示为:BaSO4(s)?Ba2+(aq)+SO42-(aq).其溶度积常数Ksp=C(Ba2+)?C(SO42-),某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )