题目内容
已知:①相同温度下溶解度:MgCO3:0.02g/100g水,Mg(OH)2:0.0009g/100g水;
②25℃时,亚磷酸(H3PO3,二元酸)的Ka1=3.7×10-2,Ka2=2.9×10-7;草酸(H2C2O4)的Ka1=5.6×10-2,Ka2=5.4×10-5
③相同条件下电离出S2-的能力:FeS>H2S>CuS,以下离子方程式错误的是( )
②25℃时,亚磷酸(H3PO3,二元酸)的Ka1=3.7×10-2,Ka2=2.9×10-7;草酸(H2C2O4)的Ka1=5.6×10-2,Ka2=5.4×10-5
③相同条件下电离出S2-的能力:FeS>H2S>CuS,以下离子方程式错误的是( )
| A、Mg2++2HCO3-+2Ca+4OH-═Mg(OH)2↓+2CaCO3↓+2H2O |
| B、Cu2++H2S═CuS↓+2H+ |
| C、FeS+2H+═H2S↑+Fe2+ |
| D、H2PO3-+C2O42-═HPO32-+HC2O4- |
考点:离子方程式的书写,难溶电解质的溶解平衡及沉淀转化的本质
专题:离子反应专题
分析:A.由①可知,Mg(OH)2更难溶,则碳酸氢镁与氢氧化钙反应生成碳酸钙、氢氧化镁、水;
B.由③可知,CuS易结合S2-;
C.由③可知,电离出S2-的能力:FeS>H2S;
D.由②可知,HC2O4-的Ka2=5.4×10-5>H2PO3-的Ka2=2.9×10-7.
B.由③可知,CuS易结合S2-;
C.由③可知,电离出S2-的能力:FeS>H2S;
D.由②可知,HC2O4-的Ka2=5.4×10-5>H2PO3-的Ka2=2.9×10-7.
解答:
解:A.由①可知,Mg(OH)2更难溶,则碳酸氢镁与氢氧化钙反应生成碳酸钙、氢氧化镁、水,离子反应为Mg2++2HCO3-+2Ca+4OH-═Mg(OH)2↓+2CaCO3↓+2H2O,故A正确;
B.由③可知,CuS易结合S2-,则Cu2++H2S═CuS↓+2H+,故B正确;
C.由③可知,电离出S2-的能力:FeS>H2S,则FeS+2H+═H2S↑+Fe2+,故C正确;
D.由②可知,HC2O4-的Ka2=5.4×10-5>H2PO3-的Ka2=2.9×10-7,HC2O4-的酸性强,则不能发生H2PO3-+C2O42-═HPO32-+HC2O4-,故D错误;
故选D.
B.由③可知,CuS易结合S2-,则Cu2++H2S═CuS↓+2H+,故B正确;
C.由③可知,电离出S2-的能力:FeS>H2S,则FeS+2H+═H2S↑+Fe2+,故C正确;
D.由②可知,HC2O4-的Ka2=5.4×10-5>H2PO3-的Ka2=2.9×10-7,HC2O4-的酸性强,则不能发生H2PO3-+C2O42-═HPO32-+HC2O4-,故D错误;
故选D.
点评:本题考查离子反应的书写,为高频考点,把握习题中的信息为解答的关键,侧重分析能力、信息处理能力及知识综合应用能力的考查,题目难度中等.

练习册系列答案
相关题目
化学实验是科学探究过程中的一神重要方法.下列有关实验的说法正确的是( )
| A、除去Cu2+(aq)中混有的少量Fe3+,可向其中通入过量的NH3 |
| B、在中和热测定的实验中,做三次平行实验最少要使用6次温度计 |
| C、FeCl3溶液与KSCN溶液混合,存在下述平衡:FeCl3+3KSCN?Fe(SCN)3+3KCl当达到平衡时,保持其他条件不变,可向其中加入固体KCl,来探究浓度对反应速率的影响 |
| D、常温下,用pH计测量等物质的量浓度的NaHC03和NaHS03溶液的pH,来探究H2CO3、H2SO3酸性的相对强弱 |
氨甲环酸和氨甲苯酸是临床上常用的止血药,其结构如图所示:
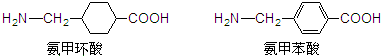
下列说法错误的是( )
下列说法错误的是( )
| A、氨甲环酸、氨甲苯酸都既能溶于盐酸,又能溶于NaOH溶液 |
| B、氨甲苯酸属于芳香族α-氨基酸的同分异构体和苯丙氨酸互为同系物 |
| C、氨甲环酸、氨甲苯酸都能发生取代、氧化、缩聚、加成等反应 |
| D、氨甲环酸、氨甲苯酸中各有5种不同的氢原子 |
松萝酸常作为牙膏和化妆品的添加剂,可由三羟基苯乙酮两步反应得到,有关说法正确的是( )
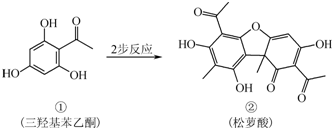

| A、有机物①的分子式为C8H8O4 |
| B、有机物②中含有1个手性碳原子 |
| C、检验②中是否含有杂质①,可用FeCl3溶液 |
| D、相同物质的量①、②与足量NaOH溶液反应,消耗NaOH的物质的量相同 |
已知有反应:Cu2O+2H+→Cu+Cu2++H2O,则可用来检验氢气还原CuO所得的红色固体中是否含Cu2O的试剂是( )
| A、稀硝酸 | B、稀硫酸 |
| C、盐酸 | D、浓硫酸 |
葡萄糖在人体中进行无氧呼吸产生乳酸,结构简式如下: ,下列有关乳酸的说法不正确的是( )
,下列有关乳酸的说法不正确的是( )
 ,下列有关乳酸的说法不正确的是( )
,下列有关乳酸的说法不正确的是( )| A、乳酸能发生催化氧化、取代反应 |
| B、乳酸和葡萄糖所含官能团相同 |
| C、乳酸能和碳酸氢钠、钠反应放出气体 |
D、乳酸和 互为同分异构体 互为同分异构体 |
某小分子抗癌药物的分子结构如图所示,下列说法正确的是( )
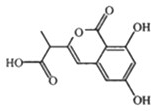

| A、1mol该有机物最多可以和5mol NaOH反应 |
| B、1mol该有机物与浓溴水反应,最多消耗3mol Br2 |
| C、该有机物遇FeCl3溶液不变色,但可使酸性KMnO4溶液褪色 |
| D、该有机物容易发生加成、取代、中和、消去等反应 |
 运用化学反应原理研究部分单质及其化合物的反应有重要意义.
运用化学反应原理研究部分单质及其化合物的反应有重要意义.