题目内容
某研究性学习小组为了研究影响化学反应速率的因素,设计如下方案:
已知:反应的方程式(未配平):KMnO4+H2C2O4+H2SO4--K2SO4+MnSO4+CO2↑+H2O
(1)实验记时方法是从溶液混合开始记时,至 时记时结束.
(2)实验I和Ⅱ研究浓度对反应速率的影响,实验Ⅰ和Ⅲ研究温度对反应速率的影响.请在上表空格中填入合理的实验数据.
(3)从实验数据分析,实验I和IV研究 对反应的影响.
(4)请配平上面的化学方程式:
KMnO4+ H2C2O4+ H2SO4= K2SO4+ MnSO4+ CO2↑+ H2O.
| 实验 编号 | 0.01mol?L-1 酸性KMnO4溶液 | 0.1mol?L-1 H2C2O4溶液 | 水 | 1mol?L-1 MnSO4溶液 | 反应温度 /℃ | 反应时间 |
| Ⅰ | 2mL | 2mL | 0 | 0 | 20 | 125 |
| Ⅱ | 1mL | 0 | 20 | 320 | ||
| Ⅲ | 0 | 50 | 30 | |||
| Ⅳ | 2mL | 2mL | 0 | 2滴 | 20 | 10 |
(1)实验记时方法是从溶液混合开始记时,至
(2)实验I和Ⅱ研究浓度对反应速率的影响,实验Ⅰ和Ⅲ研究温度对反应速率的影响.请在上表空格中填入合理的实验数据.
(3)从实验数据分析,实验I和IV研究
(4)请配平上面的化学方程式:
考点:探究温度、压强对化学反应速率的影响,氧化还原反应方程式的配平
专题:
分析:(1)溶液混合后显示紫红色,当紫红色褪去后计时结束;
(2)实验I和II研究浓度对反应速率的影响;实验I和III研究温度对反应速率的影响;
(3)MnSO4溶液为催化剂;
(4)该反应中Mn元素化合价由+7价变为+2价、C元素化合价由+3价变为+4价,根据转移电子守恒、原子守恒配平方程式.
(2)实验I和II研究浓度对反应速率的影响;实验I和III研究温度对反应速率的影响;
(3)MnSO4溶液为催化剂;
(4)该反应中Mn元素化合价由+7价变为+2价、C元素化合价由+3价变为+4价,根据转移电子守恒、原子守恒配平方程式.
解答:
解:(1)实验计时方法是从溶液混合开始记时,到紫红色刚好褪去计时结束,故答案为:紫红色刚好褪去;
(2)根据实验目的,选择合理数据:高锰酸钾作为指示剂,浓度不变,都是2mL;实验I和II研究浓度对反应速率的影响,草酸体积为1mL;实验I和III研究温度对反应速率的影响,浓度全部相同,
故答案为:
(3)从实验数据分析,MnSO4溶液在反应中为催化剂,故答案为:催化剂.
(4)该反应中Mn元素化合价由+7价变为+2价、C元素化合价由+3价变为+4价,其转移电子总数为10,根据转移电子守恒知,KMnO4的计量数是2、H2C2O4的计量数是5,再根据原子守恒得方程式为2KMnO4+5H2C2O4+3H2SO4═1K2SO4+10CO2↑+2MnSO4+8H2O,
故答案为:2;5;3;1;2;10;8.
(2)根据实验目的,选择合理数据:高锰酸钾作为指示剂,浓度不变,都是2mL;实验I和II研究浓度对反应速率的影响,草酸体积为1mL;实验I和III研究温度对反应速率的影响,浓度全部相同,
故答案为:
| II | 2 | 1 | |
| III | 2 | 2 | 0 |
(4)该反应中Mn元素化合价由+7价变为+2价、C元素化合价由+3价变为+4价,其转移电子总数为10,根据转移电子守恒知,KMnO4的计量数是2、H2C2O4的计量数是5,再根据原子守恒得方程式为2KMnO4+5H2C2O4+3H2SO4═1K2SO4+10CO2↑+2MnSO4+8H2O,
故答案为:2;5;3;1;2;10;8.
点评:本题考查影响化学反应速率的因素、氧化还原反应的配平,需要认真分析题中信息,得出合理结论,本题难度中等.

练习册系列答案
相关题目
同温同压下,下列有关等体积的二氧化碳和氢气的比较中,正确的是( )
| A、物质的量比为1:1 |
| B、密度比为11:1 |
| C、质量比为1:22 |
| D、质子数比为3:2 |
已知R2+核外有a个电子,b个中子.表示R原子符号正确的是( )
| A、R | ||
B、
| ||
C、
| ||
D、
|
实验室制备Al(OH)3沉淀,最适宜的方法是( )
| A、AlCl3溶液中加入NaOH溶液 |
| B、AlCl3溶液中加入足量氨水 |
| C、NaAlO2溶液中加入浓盐酸 |
| D、Al2O3溶于足量的热水中 |

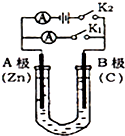 如图所示,U形管内盛有100mL的溶液,按要求回答下列问题:
如图所示,U形管内盛有100mL的溶液,按要求回答下列问题: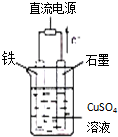 (1)已知298K时,1molC2H6在氧气中完全燃烧生成二氧化碳和液态水,利用该反应设计一个燃料电池:用氢氧化钾溶液做电解质溶液,用多孔石墨做电极,在电极上分别充入乙烷和氧气.写出负极的电极反应式
(1)已知298K时,1molC2H6在氧气中完全燃烧生成二氧化碳和液态水,利用该反应设计一个燃料电池:用氢氧化钾溶液做电解质溶液,用多孔石墨做电极,在电极上分别充入乙烷和氧气.写出负极的电极反应式