题目内容
铝土矿是工业上制铝的主要原料,现有一铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO杂质)样品,按下列实验方案测其组分的质量分数.
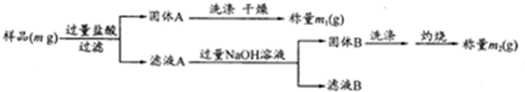
(1)洗涤固体A后的洗涤液是否需加入到滤液A中 (填“是”或“否”);理由是 ;检测固体A是否洗涤干净的方法是 .
(2)滤液A滴加过量NaOH溶液的过程中,发生的离子反应共有 个,其中发生沉淀溶解的离子反应方程式为 .
(3)该方案能测得质量分数的成分且相应的质量分数是 .

(1)洗涤固体A后的洗涤液是否需加入到滤液A中
(2)滤液A滴加过量NaOH溶液的过程中,发生的离子反应共有
(3)该方案能测得质量分数的成分且相应的质量分数是
考点:物质分离和提纯的方法和基本操作综合应用,探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:样品mg主要成分是Al2O3,含SiO2、Fe2O3、MgO杂质,加入过量盐酸过滤得到固体为SiO2,滤液A为AlCl3、FeCl3、MgCl2,加入过量氢氧化钠溶液过滤得到固体B为Fe(OH)3,Mg(OH)2,洗涤灼烧得到固体Fe2O3、MgO质量为m2g,滤液B为NaAlO2;
(1)洗涤固体A的洗涤液中含有其他杂质离子,检验固体A洗涤是否干净,设计实验检验是否含有铁离子检验;
(2)滤液A为AlCl3、FeCl3、MgCl2,滴加过量NaOH溶液的过程中发生的反应:中和盐酸的反应、生成氢氧化铝沉淀、氢氧化铝溶解、生成氢氧化铁沉淀、氢氧化镁沉淀,沉淀溶解的反应为氢氧化铝和氢氧化钠反应生成偏铝酸钠和水;
(3)该方案能测得质量分数的成分为二氧化硅、氧化铝,结合质量关系计算得到;
(1)洗涤固体A的洗涤液中含有其他杂质离子,检验固体A洗涤是否干净,设计实验检验是否含有铁离子检验;
(2)滤液A为AlCl3、FeCl3、MgCl2,滴加过量NaOH溶液的过程中发生的反应:中和盐酸的反应、生成氢氧化铝沉淀、氢氧化铝溶解、生成氢氧化铁沉淀、氢氧化镁沉淀,沉淀溶解的反应为氢氧化铝和氢氧化钠反应生成偏铝酸钠和水;
(3)该方案能测得质量分数的成分为二氧化硅、氧化铝,结合质量关系计算得到;
解答:
解:样品mg主要成分是Al2O3,含SiO2、Fe2O3、MgO杂质,加入过量盐酸过滤得到固体为SiO2,滤液A为AlCl3、FeCl3、MgCl2,加入过量氢氧化钠溶液过滤得到固体B为Fe(OH)3,Mg(OH)2,洗涤灼烧得到固体Fe2O3、MgO质量为m2g,滤液B为NaAlO2;
(1)洗涤固体A的洗涤液中含有其他杂质离子Al3+、Fe3+、Mg2+,洗涤固体A后的洗涤液是需加入到滤液A中,减少损失,检验固体A洗涤是否干净,设计实验检验是否含有铁离子检验,取最后一次洗涤液与少许试管中,滴入几滴KSCN溶液,溶液不变红,说明洗涤干净;
故答案为:是,取最后一次洗涤液与少许试管中,滴入几滴KSCN溶液,溶液不变红,说明洗涤干净;
(2)滤液A为AlCl3、FeCl3、MgCl2,滴加过量NaOH溶液的过程中发生的反应:中和盐酸的反应、生成氢氧化铝沉淀、氢氧化铝溶解、生成氢氧化铁沉淀、氢氧化镁沉淀,共5个反应,沉淀溶解的反应为氢氧化铝和氢氧化钠反应生成偏铝酸钠和水,反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O;
故答案为:5,Al(OH)3+OH-=AlO2-+2H2O;
(3)该方案能测得质量分数的成分为二氧化硅、氧化铝,结合质量关系计算得到,流程中m1为二氧化硅的质量,质量分数=
×100%,得到固体质量m2g为Fe2O3、MgO的质量,所以氧化铝的质量=m=m1-m2,氧化铝质量分数=
×100%;
故答案为:SiO2,
×100% Al2O3,
×100%;
(1)洗涤固体A的洗涤液中含有其他杂质离子Al3+、Fe3+、Mg2+,洗涤固体A后的洗涤液是需加入到滤液A中,减少损失,检验固体A洗涤是否干净,设计实验检验是否含有铁离子检验,取最后一次洗涤液与少许试管中,滴入几滴KSCN溶液,溶液不变红,说明洗涤干净;
故答案为:是,取最后一次洗涤液与少许试管中,滴入几滴KSCN溶液,溶液不变红,说明洗涤干净;
(2)滤液A为AlCl3、FeCl3、MgCl2,滴加过量NaOH溶液的过程中发生的反应:中和盐酸的反应、生成氢氧化铝沉淀、氢氧化铝溶解、生成氢氧化铁沉淀、氢氧化镁沉淀,共5个反应,沉淀溶解的反应为氢氧化铝和氢氧化钠反应生成偏铝酸钠和水,反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O;
故答案为:5,Al(OH)3+OH-=AlO2-+2H2O;
(3)该方案能测得质量分数的成分为二氧化硅、氧化铝,结合质量关系计算得到,流程中m1为二氧化硅的质量,质量分数=
| m1 |
| m |
| m-m1-m2 |
| m |
故答案为:SiO2,
| m1 |
| m |
| m-m1-m2 |
| m |
点评:本题考查了物质分离提纯的流程分析判断,物质定量测定,反应过程分析应用,掌握基础是关键,题目难度中等.

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
点豆腐所采用的凝聚剂是( )
| A、石膏 | B、硫酸钾 |
| C、氯化钡 | D、六水氯化镁 |
将标准状况下11.2L的HCl气体溶解于水配成1L溶液,所得溶液的浓度是( )
| A、2mol/L |
| B、1.5mol/L |
| C、1mol/L |
| D、0.5mol/L |
 用图表示的一些物质或概念之间的从属或包含关系中,错误的是( )
用图表示的一些物质或概念之间的从属或包含关系中,错误的是( )