题目内容
NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、一定条件下,1molN2和3molH2充分反应,生成物中的N-H键数目为6NA |
| B、完全燃烧1.5molCH3CH2OH和C2H4的混合物,转移电子数为18NA |
| C、100g 98%的浓硫酸中含氧原子个数为4NA |
| D、1L 0.1 mol/L的Na2S溶液中S2-和HS-的总数为0.1NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.氮气与氢气反应生成氨气为可逆反应;
B.1molCH3CH2OH、C2H4完全燃烧消耗氧气都是3mol,转移电子数都是4×3NA;
C.浓硫酸溶液中硫酸、水都含有氧原子;
D.硫离子为多元弱酸根离子存在两步水解:S2-+H2O HS-+OH-;HS-+H2O
HS-+OH-;HS-+H2O  H2S+OH-.
H2S+OH-.
B.1molCH3CH2OH、C2H4完全燃烧消耗氧气都是3mol,转移电子数都是4×3NA;
C.浓硫酸溶液中硫酸、水都含有氧原子;
D.硫离子为多元弱酸根离子存在两步水解:S2-+H2O
 HS-+OH-;HS-+H2O
HS-+OH-;HS-+H2O  H2S+OH-.
H2S+OH-.解答:
解:A.氮气与氢气反应生成氨气为可逆反应,可逆反应不能朝着一个方向进行到底,1molN2和3molH2充分反应,生成的氨气小于2mol,生成N-H键数目小于6NA,故A错误;
B.1molCH3CH2OH、C2H4完全燃烧消耗氧气都是3mol,转移电子数都是4×3NA,所以完全燃烧1.5molCH3CH2OH和C2H4的混合物,转移电子数为18NA,故B正确;
C.浓硫酸溶液中硫酸、水都含有氧原子,所以100g 98%的浓硫酸中含氧原子个数远远大于4NA,故C错误;
D.硫离子为多元弱酸根离子存在两步水解:S2-+H2O HS-+OH-;HS-+H2O
HS-+OH-;HS-+H2O H2S+OH-,依据物料守恒可知:1L 0.1 mol/L的Na2S溶液中S2-和HS-、H2S,总数为0.1NA,故D错误;
H2S+OH-,依据物料守恒可知:1L 0.1 mol/L的Na2S溶液中S2-和HS-、H2S,总数为0.1NA,故D错误;
故选:B.
B.1molCH3CH2OH、C2H4完全燃烧消耗氧气都是3mol,转移电子数都是4×3NA,所以完全燃烧1.5molCH3CH2OH和C2H4的混合物,转移电子数为18NA,故B正确;
C.浓硫酸溶液中硫酸、水都含有氧原子,所以100g 98%的浓硫酸中含氧原子个数远远大于4NA,故C错误;
D.硫离子为多元弱酸根离子存在两步水解:S2-+H2O
 HS-+OH-;HS-+H2O
HS-+OH-;HS-+H2O H2S+OH-,依据物料守恒可知:1L 0.1 mol/L的Na2S溶液中S2-和HS-、H2S,总数为0.1NA,故D错误;
H2S+OH-,依据物料守恒可知:1L 0.1 mol/L的Na2S溶液中S2-和HS-、H2S,总数为0.1NA,故D错误;故选:B.
点评:本题考查了阿伏伽德罗常数的应用,侧重考查可逆反应、电子转移的计算、微粒个数的计算,明确可逆反应特点、熟悉盐溶液中存在的物料守恒是解题关键,题目难度中等.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
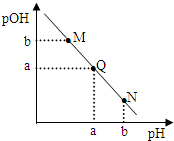 某温度下,向一定体积的0.1mol/L的醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH与pH的关系如图[已知:pOH=-lgc(OH-)],下列说法正确的是
某温度下,向一定体积的0.1mol/L的醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH与pH的关系如图[已知:pOH=-lgc(OH-)],下列说法正确的是( )
| A、M点溶液导电能力强于Q点溶液导电能力 |
| B、N点所示溶液中,c(CH3COO-)>c(Na+) |
| C、M点与N点所示溶液中水的电离程度相等 |
| D、Q点消耗NaOH溶液体积等于醋酸溶液的体积 |
化学与社会、生活密切相关,下列说法正确的是( )
| A、“歼-20”飞机上使用的碳纤维是一种新型的有机高分子材料 |
| B、工业上通常用电解Na、Mg、Al对应的氯化物制取该三种金属单质 |
| C、Fe3O4俗称铁红,常做红色油漆和涂料 |
| D、燃料电池的燃料都在负极发生氧化反应 |
有机物:C2H2 C4H4 C6H6 C8H8,有关其性质叙述中不正确的是( )
| A、碳的质量分数相同 |
| B、固态时均为分子晶体 |
| C、一定条件下能与H2发生加成反应,就一定能使KMnO4酸性溶液褪色 |
| D、C8H8可能含有苯环结构 |
下列有关阿伏伽德罗常数的说法正确的是( )
| A、常温常压下,28g氮气含有的核外电子数为10 NA |
| B、1mol铜单质被还原为1molCu2+时转移电子数为2NA个 |
| C、在标准状况下,以任意比例混合的CH4与CO2 的混合物22.4L,所含有的分子数为NA |
| D、1mol石墨中含有2NA个C-C键 |
下列叙述正确的是( )
| A、物质的量是衡量物质质量大小的物理量 |
| B、摩尔质量即相对分子质量 |
| C、气体摩尔体积是指单位物质的量的物质所占的体积 |
| D、物质的量浓度表示单位体积的溶液中所含溶质的物质的量 |
取一定质量的均匀固体混合物Cu、Cu2O和 CuO,将其分成两等份,取其中一份用足量的氢气还原,测得反应后固体质量减少6.40g,另一份中加入500mL稀硝酸,固体恰好完全溶解,且同时收集到标准状况下NO气体4.48L,则所用硝酸的物质的量浓度为( )
| A、2.8mol?L-1 |
| B、3.2mol?L-1 |
| C、3.6mol?L-1 |
| D、无法判断 |
