题目内容
9.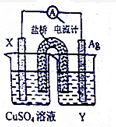 I、依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题:
I、依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题:(1)银电极上的电极反应为Ag++e-=Ag.
(2)若以铅蓄电池做电源,以X和Ag作电极,电解一定浓度的CuSO4溶液.已知Ag连接铅蓄电池的负极,则X电极上的电极反应为Cu-2e-=Cu2+,电解一段时间后溶液的pH不变(填“增大”、“减小”或“不变”)
Ⅱ、以铂和锌为电极材料,埋入人体内作心脏起搏器的能源,它依靠人体血液中有一定浓度的O2进行工作,则该能源正极材料是Pt电极反应是O2+4e-+4H+=2H2O.
分析 Ⅰ、(1)2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池中,金属铜X是负极,银是正极,根据原电池的工作原理来回答;
(2)以铅蓄电池做电源,以Cu和Ag作电极,Ag连接铅蓄电池的负极,所以Ag是阴极,Cu是阳极,根据电解池的工作原理来回答;
Ⅱ、Zn、Pt和电解质溶液构成原电池,Zn作负极、Pt作正极,正极上氧气得电子发生还原反应生成水,据此分析解答.
解答 解:Ⅰ、(1)2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池中,金属铜X是负极,银是正极,银电极上的电极反应为Ag++e-=Ag,故答案为:Ag++e-=Ag;
(2)以铅蓄电池做电源,以Cu和Ag作电极,Ag连接铅蓄电池的负极,所以Ag是阴极,X电极Cu是阳极,电解一定浓度的CuSO4溶液,则阳极上发生反应:Cu-2e-=Cu2+,
阴极上发生反应:Cu2++2e-=Cu,电解一段时间后溶液的pH不变,故答案为:Cu-2e-=Cu2+;不变;
Ⅱ、Zn、Pt和电解质溶液构成原电池,Zn作负极、Pt作正极,电解质溶液呈酸性,正极上氧气得电子发生还原反应生成水,电极反应式为O2+4e-+4H+=2H2O,
负极上锌失电子发生氧化反应生成锌离子,电极反应式为Zn-2e-=Zn2+,
故答案为:Pt;O2+4e-+4H+=2H2O.
点评 本题考查了原电池、电解池的工作原理,涉及电极和电解质的判断、电极方程式的书写等,侧重于基础知识的考查,题目难度不大.

练习册系列答案
相关题目
20.下列离子方程式正确的是( )
| A. | 用铜为电极电解饱和食盐水:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| B. | 浓硝酸溶液中加入过量铁粉并加热:Fe+3NO3-+6H+$\frac{\underline{\;\;△\;\;}}{\;}$Fe3++3NO2↑+3H2O | |
| C. | 0.01mol/LNH4Al(SO4)2溶液与0.02mol/LBa(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+Al(OH)3↓+NH3•H2O | |
| D. | 向小苏打溶液中加少量Ba(OH)2溶液:HCO3-+Ba2++OH-═BaCO3↓+H2O |
4.在4FeO42-+20H+═4Fe3++3O2↑+10□反应中,下列说法正确的是( )
| A. | FeO42- 只做氧化剂 | |
| B. | O2是还原产物 | |
| C. | □处对应的物质是H2O | |
| D. | 若10 mol H+参加反应,转移的电子的物质的量是10 mol |
14.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 1.0mol•L-1KNO3溶液:H+、Fe2+、SCN-、SO42- | |
| B. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=10-10的溶液:S2-、NO3-、Cl-、Na+ | |
| C. | 0.1 mol•L-1的Na2CO3溶液:K+、Ba2+、NO3-、Cl- | |
| D. | 由水电离出来的c(H+)=10-10mol•L-1的溶液:Na+、SO42-、S2-、HCO3- |
18.下列离子方程式正确的是( )
| A. | CH3COOH在水中电离:CH3COOH═H++CH3COO- | |
| B. | Na2CO3溶液与足量盐酸反应:CO32-+H+═HCO3ˉ | |
| C. | 大理石中加入稀盐酸:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | MgC12溶液与过量氨水反应:Mg2++2OH-═Mg(OH)2↓ |
19.某工厂用如图所示的流程图除去工业废气中含有的H2S,下列说法中正确的是( )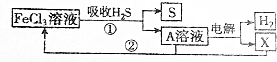

| A. | A溶液中溶质的成分为FeCl2 | B. | X为Cl2并且在阴极上生成的 | ||
| C. | 废气中的H2S最终转化为S和H2 | D. | 只有流程①为氧化还原反应 |

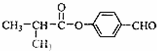 ;
;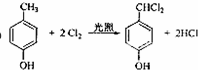 ;
;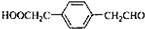 .
.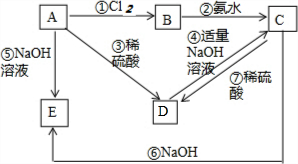 已知金属A为常见的金属单质,根据下列物质的转化关系完成各小题(图中表示主要物质的转化关系,反应中生成的水、气体等物质未标出)
已知金属A为常见的金属单质,根据下列物质的转化关系完成各小题(图中表示主要物质的转化关系,反应中生成的水、气体等物质未标出)