题目内容
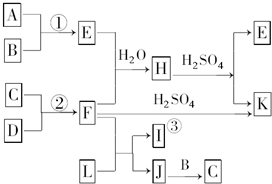
用H2C2O4?2H2O滴加浓H2SO4制备CO,通入灼热的铁的氧化物粉末中,做炼铁实验.但此法制备的CO中含有其他气体,必须除去.现有下列装置:

根据题目要求,回答下列问题:
(1)写出H2C2O4?2H2O在浓硫酸催化作用下制备CO的化学方程式. ;
(2)用a~h表示连接顺序,正确顺序为:
a→ → → → → → → →i
(3)用A~F正确表示下面实验操作的先后顺序: .
A.点燃甲装置的酒精灯,打开分液漏斗,调节浓硫酸的滴速.
B.点燃乙装置中的酒精灯,加热氧化铁.
C.检查整套装置的气密性.
D.将导管口i处的尾气验纯后,点燃加以处理.
E.待乙装置玻璃管内的Fe2O3完全变黑时,熄灭乙装置中的酒精灯.
F.关好甲装置中分液漏斗的开关后,再熄灭该装置中的酒精灯.
(4)空洗气瓶的作用是
(5)假设乙中所装为铁氧化物的混合物,可能是FeO、Fe2O3、Fe3O4的任意组合,现取a克混合物充分反应后,质量减轻了8a/29克,通过计算确定该混合物中三种氧化物的物质的量的关系为 .

根据题目要求,回答下列问题:
(1)写出H2C2O4?2H2O在浓硫酸催化作用下制备CO的化学方程式.
(2)用a~h表示连接顺序,正确顺序为:
a→
(3)用A~F正确表示下面实验操作的先后顺序:
A.点燃甲装置的酒精灯,打开分液漏斗,调节浓硫酸的滴速.
B.点燃乙装置中的酒精灯,加热氧化铁.
C.检查整套装置的气密性.
D.将导管口i处的尾气验纯后,点燃加以处理.
E.待乙装置玻璃管内的Fe2O3完全变黑时,熄灭乙装置中的酒精灯.
F.关好甲装置中分液漏斗的开关后,再熄灭该装置中的酒精灯.
(4)空洗气瓶的作用是
(5)假设乙中所装为铁氧化物的混合物,可能是FeO、Fe2O3、Fe3O4的任意组合,现取a克混合物充分反应后,质量减轻了8a/29克,通过计算确定该混合物中三种氧化物的物质的量的关系为
考点:常见气体制备原理及装置选择
专题:实验题
分析:(1)草酸晶体在浓硫酸作催化剂、加热的条件下,发生分解反应,根据碳元素的化合价变化可知,除生成一氧化碳外还有二氧化碳生成;
(2)根据原理和各装置的作用连接,得到纯净干燥的一氧化碳应先除去二氧化碳后干燥,除去二氧化碳要防止溶液倒吸;
(3)制备气体要先检验装置的气密性,然后加料制备CO并用CO排尽装置难度空气,CO有毒,污染空气,验纯后,点燃处理,再进行用CO炼铁实验,使用结束,为防止铁被氧化,冷却后,停止通CO;
(4)除去二氧化碳要防止溶液倒吸;
(5)质量减轻
g,为ag铁氧化物的混合物所含氧原子的质量,由此计算混合物中铁原子的质量,再求出混合物中铁原子与氧原子的个数比,据此确定混合物组成及混合物中各组分的物质的量关系.
(2)根据原理和各装置的作用连接,得到纯净干燥的一氧化碳应先除去二氧化碳后干燥,除去二氧化碳要防止溶液倒吸;
(3)制备气体要先检验装置的气密性,然后加料制备CO并用CO排尽装置难度空气,CO有毒,污染空气,验纯后,点燃处理,再进行用CO炼铁实验,使用结束,为防止铁被氧化,冷却后,停止通CO;
(4)除去二氧化碳要防止溶液倒吸;
(5)质量减轻
| 8a |
| 29 |
解答:
解:(1)草酸晶体在浓硫酸作催化剂、加热的条件下,发生分解反应,根据碳元素的化合价变化可知,除生成一氧化碳外还有二氧化碳生成,反应方程式为
H2C2O4?2H2O
CO↑+CO2↑+3H2O,
故答案为:H2C2O4?2H2O
CO↑+CO2↑+3H2O;
(2)得到纯净干燥的一氧化碳应先除去二氧化碳后干燥,除去二氧化碳要防止溶液倒吸,所以装置的连接顺序为a接d;e 接g;f 接c; b 接h,
故答案为:d e g f c b h;
(3)制备气体要先检验装置的气密性,然后加料制备CO并用CO排尽装置难度空气,CO有毒,污染空气,验纯后,点燃处理,再进行用CO炼铁实验,使用结束,为防止铁被氧化,冷却后,停止通CO.所以操作步骤顺序为CADBEF,故答案为:CADBEF;
(4)除去二氧化碳要防止溶液倒吸,进入乙装置的气体应干燥,所以空洗气瓶的作用是防倒吸,
故答案为:防倒吸;
(5)ag铁氧化物的混合物所含铁原子的质量为(a-
)g=
g,
所以混合物中n(Fe):n(O)=
:
=3:4,
由于Fe3O4中铁原子与氧原子的个数比为3:4,只要FeO与Fe2O3保证混合铁原子与氧原子的个数比为3:4,即可,与Fe3O4任意含量无关,
令n(FeO)为x,n(Fe2O3)为y,所以有(x+2y):(x+3y)=3:4,即x:y=1:1,
且满足三者质量之和为ag,即72n(FeO)+160n(Fe2O3)+232n(Fe3O4)=a
故答案为:n(FeO):n(Fe2O3)=1:1,n(Fe3O4)≥0;72n(FeO)+160n(Fe2O3)+232n(Fe3O4)=a.
H2C2O4?2H2O
| 浓H2SO4 |
| △ |
故答案为:H2C2O4?2H2O
| 浓H2SO4 |
| △ |
(2)得到纯净干燥的一氧化碳应先除去二氧化碳后干燥,除去二氧化碳要防止溶液倒吸,所以装置的连接顺序为a接d;e 接g;f 接c; b 接h,
故答案为:d e g f c b h;
(3)制备气体要先检验装置的气密性,然后加料制备CO并用CO排尽装置难度空气,CO有毒,污染空气,验纯后,点燃处理,再进行用CO炼铁实验,使用结束,为防止铁被氧化,冷却后,停止通CO.所以操作步骤顺序为CADBEF,故答案为:CADBEF;
(4)除去二氧化碳要防止溶液倒吸,进入乙装置的气体应干燥,所以空洗气瓶的作用是防倒吸,
故答案为:防倒吸;
(5)ag铁氧化物的混合物所含铁原子的质量为(a-
| 8a |
| 29 |
| 21a |
| 29 |
所以混合物中n(Fe):n(O)=
| ||
| 56g/mol |
| ||
| 16g/mol |
由于Fe3O4中铁原子与氧原子的个数比为3:4,只要FeO与Fe2O3保证混合铁原子与氧原子的个数比为3:4,即可,与Fe3O4任意含量无关,
令n(FeO)为x,n(Fe2O3)为y,所以有(x+2y):(x+3y)=3:4,即x:y=1:1,
且满足三者质量之和为ag,即72n(FeO)+160n(Fe2O3)+232n(Fe3O4)=a
故答案为:n(FeO):n(Fe2O3)=1:1,n(Fe3O4)≥0;72n(FeO)+160n(Fe2O3)+232n(Fe3O4)=a.
点评:本题考查了气体制备和装置选择、实验的步骤,题目综合性强,以实验为载体,综合考查学生化学计算、推断能力和对氧化还原反应、实验原理及装置的理解.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目