题目内容
5.已知:①向KMnO4晶体滴加浓盐酸,产生黄绿色气体;②向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;下列判断正确的为( )| A. | 上述实验中,只有一个氧化还原反应 | |
| B. | 实验①中 产物是Cl2 和HMnO4 | |
| C. | 实验①中浓盐酸不仅仅体现酸性 | |
| D. | 实验②可证明Fe2+既有氧化性又有还原性 |
分析 ①向KMnO4晶体滴加浓盐酸,产生黄绿色气体,该反应中Mn元素化合价由+7价变为+2价、Cl元素化合价由-1价变为0价,高锰酸钾是氧化剂、浓盐酸是还原剂;
②向FeCl2溶液中通入少量氯气,溶液变黄色,铁元素化合价由+2价变为+3价、Cl元素化合价由0价变为-1价,氯化亚铁是还原剂、氯气是氧化剂;以此解答.
解答 解:①向KMnO4晶体滴加浓盐酸,产生黄绿色气体,该反应中Mn元素化合价由+7价变为+2价、Cl元素化合价由-1价变为0价,高锰酸钾是氧化剂、浓盐酸是还原剂,氧化性:MnO4->Cl2;
②向FeCl2溶液中通入少量氯气,溶液变黄色,铁元素化合价由+2价变为+3价、Cl元素化合价由0价变为-1价,氯化亚铁是还原剂、氯气是氧化剂,氧化性:Cl2>Fe3+;
A.2个反应都为氧化还原反应,故A错误;
B.实验①中 产物是Cl2 和MnCl2等,故B错误;
C.实验①中浓盐酸作还原剂体现还原性,生成盐,体现酸性,所以不仅仅体现酸性,故C正确;
D.实验②可证明Fe2+作还原剂,体现了还原性,故D错误.
故选C.
点评 本题考查氧化还原反应以及氯气的化学性质,题目难度不大,在学习中要注意比较氧化性、还原性的方法,物质表现的性质等问题.

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目
16.有两份组成及质量都相等的Na2O2和Na2CO3的混合物,向第一份中加入足量的稀硫酸,放出的气体共4.48L.将此气体通入第二份混合物,充分反应后,气体体积变为4.032L(均为标准状况下体积).则原混合物中Na2O2和Na2CO3的物质的量之比为( )
| A. | 2:9 | B. | 3:2 | C. | 2:1 | D. | 8:1 |
20.下列关于物质的用途,叙述不正确的是( )
| A. | 过氧化钠可用作供氧剂 | B. | 三氧化二铁可用做漆料 | ||
| C. | 镁铝合金可用作制造飞机的材料 | D. | 高纯硅用来制造光导纤维 |
10.下列措施不合理的是( )
| A. | 用SO2漂白纸浆、毛、丝等 | B. | 用焦炭高温还原SiO2制粗硅 | ||
| C. | 用明矾对自来水进行杀菌消毒 | D. | 用Na2S作沉淀剂除去污水中的Hg2+ |
17.下列物质常用于工业生产制冷剂的是( )
| A. | 液氨 | B. | 液氧 | C. | 液氯 | D. | 液氢 |
14.下列物质不属于电解质的是( )
| A. | Na2CO3 | B. | H2SO4 | C. | Cu | D. | NaOH |
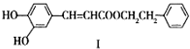 不饱和酯类化合物在药物、涂料等方面应用广泛.
不饱和酯类化合物在药物、涂料等方面应用广泛. .
.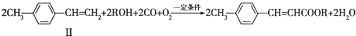
 (写1种);由Ⅳ生成Ⅱ的反应条件为氢氧化钠的醇溶液、加热.
(写1种);由Ⅳ生成Ⅱ的反应条件为氢氧化钠的醇溶液、加热.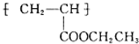 可用于制备涂料.其单体的结构简式为CH2=CHCOOCH2CH3.利用类似反应①的方法,仅以乙烯为有机原料合成该单体,涉及的反应方程式为CH2=CH2+H2O$\stackrel{一定条件}{→}$CH3CH2OH,2CH2=CH2+2CH3CH2OH+2CO+O2$\stackrel{一定条件}{→}$2CH2=CHCOOCH2CH3+2H2O.
可用于制备涂料.其单体的结构简式为CH2=CHCOOCH2CH3.利用类似反应①的方法,仅以乙烯为有机原料合成该单体,涉及的反应方程式为CH2=CH2+H2O$\stackrel{一定条件}{→}$CH3CH2OH,2CH2=CH2+2CH3CH2OH+2CO+O2$\stackrel{一定条件}{→}$2CH2=CHCOOCH2CH3+2H2O.
