题目内容
20.下列关于物质的用途,叙述不正确的是( )| A. | 过氧化钠可用作供氧剂 | B. | 三氧化二铁可用做漆料 | ||
| C. | 镁铝合金可用作制造飞机的材料 | D. | 高纯硅用来制造光导纤维 |
分析 A.过氧化钠与水、二氧化碳反应都生成氧气;
B.三氧化二铁为红棕色固体;
C.依据镁铝合金的性能解答;
D.光导纤维主要成分是二氧化硅.
解答 解:A.过氧化钠与水、二氧化碳反应都生成氧气,所以过氧化钠可用作供氧剂,故A正确;
B.三氧化二铁为红棕色固体,可用做漆料,故B正确;
C.镁铝合金密度小,硬度大,常用作航空材料,故C正确;
D.光导纤维主要成分是二氧化硅,不是硅,故D错误;
故选:D.
点评 本题考查了物质的用途,性质决定用途,明确相关的性质是解题关键,题目难度不大,注意对基础知识的积累.

练习册系列答案
相关题目
11.80°C,0.1mol/L NaHB溶液中c(H+)>c(OH-),可能正确的关系是( )
| A. | c(Na+)+c(H+)=c(HB-)+2c(B2-) | B. | 溶液的pH=1 | ||
| C. | c(H+)?c(OH-)=10-14 | D. | c(Na+)=c(H2B)+c(HB-) |
8.常见的有机反应类型有①取代反应 ②加成反应 ③消去反应 ④酯化反应 ⑤缩聚反应⑥水解反应 ⑦还原反应,其中可能在有机物分子中重新生成羟基的反应类型有( )
| A. | ①②③④ | B. | ①②⑥⑦ | C. | ①②④⑤ | D. | ④⑤⑥⑦ |
15.下列气体为红棕色的是( )
| A. | NO2 | B. | NO | C. | SO2 | D. | N2 |
5.已知:①向KMnO4晶体滴加浓盐酸,产生黄绿色气体;②向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;下列判断正确的为( )
| A. | 上述实验中,只有一个氧化还原反应 | |
| B. | 实验①中 产物是Cl2 和HMnO4 | |
| C. | 实验①中浓盐酸不仅仅体现酸性 | |
| D. | 实验②可证明Fe2+既有氧化性又有还原性 |
12.2015年,我国科学家屠呦呦因发现青蒿素而荣获诺贝尔奖.由植物黄花蒿叶中提取的青蒿素还可合成用于抗氯喹恶性疟及凶险型疟疾的蒿甲醚,其合成路线如下:

下列说法不正确的是( )

下列说法不正确的是( )
| A. | 青蒿素的分子式是C15H21O4 | |
| B. | 青蒿素可以发生水解反应 | |
| C. | 反应②有H2O生成 | |
| D. | 双氢青蒿素中含有与H2O2分子中相同的化学键 |
9.用以下三种途径来制取等质量的硝酸铜.?
①铜与稀硝酸反应;?②铜与浓硝酸反应;?③铜先与氧气反应生成氧化铜,氧化铜再跟硝酸反应.
以下叙述不正确的是( )
①铜与稀硝酸反应;?②铜与浓硝酸反应;?③铜先与氧气反应生成氧化铜,氧化铜再跟硝酸反应.
以下叙述不正确的是( )
| A. | 三种途径所消耗的铜的质量相等? | |
| B. | 所消耗的硝酸的物质的量是①>②>③?? | |
| C. | 途径③的制备方法是最符合“绿色化学”理念的? | |
| D. | 途径①中被氧化的铜与被还原的硝酸的物质的量比是3:2 |
10.下列除去杂质(括号中的物质为杂质)的方法中,不正确的是( )
| A. | FeCl3溶液(FeCl2):通入适量Cl2 | |
| B. | Fe2O3固体(Al2O3):加入足量的盐酸,过滤 | |
| C. | CO气体(CO2):通过NaOH溶液洗气后干燥 | |
| D. | Cl2气体(HCl):通过饱和NaCl溶液洗气后干燥 |

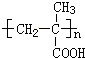 .
.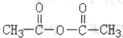 )作用制得.水杨酸的结构简式是
)作用制得.水杨酸的结构简式是 ,水杨酸可以看作羧酸类有机物,也可看作酚类有机物.
,水杨酸可以看作羧酸类有机物,也可看作酚类有机物.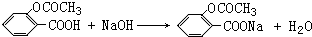 .
.