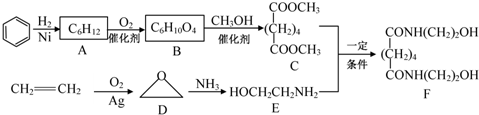
题目内容
13.把0.2mol X气体和0.4mol Y气体混合于2L密闭容器中,使它们发生如下反应:4X(g)+5Y(g)═nZ(g)+6W(g),2min末生成0.3mol W.若测知Z的浓度变化表示的反应速率为0.05mol•L-1•min -1.计算:①前2min内用Y 的浓度变化表示的反应速率为0.0625mol•L-1•min-1
②化学方程式中n的值是4.
分析 (1)先根据W的物质的量求出Y的物质的量的变化量,根据v=$\frac{△n}{△t}$计算v(Y);
(2)若测知Z的浓度变化表示的反应速率为0.05mol•L-1•min -1,利用速率概念写出计算Z的化学反应速率的表达式,计算得到n的值.
解答 解:把0.2mol X气体和0.4mol Y气体混合于2L密闭容器中,使它们发生如下反应,2min末生成0.3mol W.
4X(g)+5Y(g)═nZ(g)+6W(g),
起始量(mol) 0.2 0.4 0 0
变化量(mol) 0.2 0.25 0.05n 0.3
2min末量(mol) 0 0.15 0.05n 0.3
①前2min内用Y 的浓度变化表示的反应速率=$\frac{\frac{0.25mol}{2L}}{2min}$=0.0625mol/(L•min)
故答案为:0.0625;
②若测知Z的浓度变化表示的反应速率为0.05mol•L-1•min -1,
$\frac{\frac{0.05nmol}{2L}}{2min}$=0.05mol/(L•min)
n=4
故答案为:4.
点评 本题考查化学反应速率的计算,主要是概念的实质理解应用,题目难度不大,注意基础知识的掌握.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
3.NaNO2是一种食品添加剂,它能致癌.酸性KMnO4溶液与NaNO2的反应方程式是:MnO4-+NO2-+H+→Mn2++NO3-+H2O(未配平).下列叙述中正确的是( )
| A. | 该反应中NO2-是还原剂 | |
| B. | 反应过程中溶液的pH减小 | |
| C. | 生成1mol NaNO3时消耗0.4mol KMnO4 | |
| D. | 该反应可说明氧化性MnO4-<NO3- |
4.某导电性塑料的结构如图所示,合成该塑料的单体为( )

| A. | 乙炔 | B. | 乙烯 | C. | 乙烷 | D. | 甲烷 |
1.设N A代表阿伏加德罗常数,下列叙述中不正确的是( )
| A. | 在 28 g 聚乙烯树脂中,含有的碳原子个数为2N A | |
| B. | 在合成 28 g 聚乙烯树脂的单体中,含有的双键数目为N A | |
| C. | 28 g 聚乙烯树脂完全燃烧时,转移的电子数目为3N A | |
| D. | 28 g 聚乙烯树脂中,含有的C-H的数目为4N A |
8.下列说法正确的是( )
| A. | 甲烷是最简单的烃,其含碳量最高 | |
| B. | 可以利用燃烧的现象鉴别甲烷和乙烯 | |
| C. | 乙醇、乙酸均能与钠反应放出H2,二者分子中官能团相同 | |
| D. | 乙烯、聚乙烯和苯分子均含有碳碳双键 |
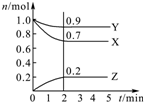 某温度时,在2L密闭容器中,三种气态物质X、Y、Z的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析可得:
某温度时,在2L密闭容器中,三种气态物质X、Y、Z的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析可得: