题目内容
配平下列方程式:
Cr2O72-+ Br-+ → Cr3++ BrO3- H2O.
考点:氧化还原反应方程式的配平
专题:
分析:反应中Cr2O72-→Cr3+,Cr元素由+6价降低为+3价,共降低6价,Br-→BrO3-,化合价从-1价升高到+5价,共升高6价,化合价最小公倍数为6,则Cr2O72-的系数为1,BrO3-的系数为1,然后根据质量守恒和电荷守恒确定缺项,配平该离子方程式.
解答:
解:反应中Cr2O72-→Cr3+,Cr元素由+6价降低为+3价,共降低6价,Br-→BrO3-,化合价从-1价升高到+5价,化合价升高6价,化合价最小公倍数为6,则Cr2O72-的系数为1,BrO3-的系数为1,配平可得:Cr2O72-+Br-+____→2Cr3++BrO3-+4H2O,根据质量守恒和电荷守恒,缺项为H+,系数为8,
故答案为:1、1、8H+、2、1、4.
故答案为:1、1、8H+、2、1、4.
点评:本题考查了氧化还原反应的配平,明确氧化还原反应的实质及配平方法,根据质量守恒定律和电荷守恒确定缺项.

练习册系列答案
相关题目
取100mL0.3mol/L的H2SO4溶液和300mL 0.25mol/L的H2SO4溶液注入500mL容量瓶中,再加水至刻度线,所得溶液中C(H2SO4)为.( )
| A、0.265mol/L |
| B、0.525mol/L |
| C、0.21mol/L |
| D、0.42mol/L |
下列离子方程式表达不正确的是( )
| A、在硫酸亚铁溶液中通入氧气:4Fe2++O2+4H+=4Fe3++2H2O |
| B、向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:Ba2++2OH-+H++SO42-+NH4+=BaSO4↓+NH3?H2O+H2O |
| C、从酸化的海带灰浸出液中提取碘:2I-+H2O2=I2+2OH- |
| D、大理石溶于醋酸中:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O |
下列说法正确的是( )
| A、电离平衡常数受溶液浓度的影响 | ||||
| B、电离常数大的酸溶液中c(H+)一定比电离常数小的酸溶液中的大 | ||||
| C、电离平衡常数可以表示弱电解质的相对强弱 | ||||
D、H2CO3的电离常数表达式:K=
|
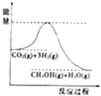 一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),该反应的能量变化如图所示:
一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),该反应的能量变化如图所示:
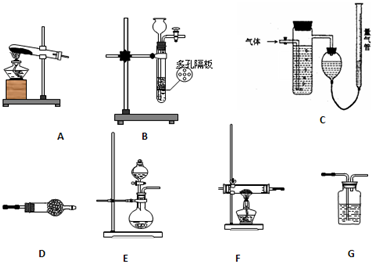 为测定氨分子中氮、氢原子个数比,某研究性学习小组用浓氨水和氧化钙反应制取氨气,然后用氨气与氧化铜粉末发生氧化还原反应.设计了如下实验流程:实验中,先检查装置气密性;然后用制得的氨气排尽洗气瓶前所有装置中的空气;再连接洗气瓶和气体测量装置;立即加热氧化铜.反应完成后,黑色的氧化铜转化为红色的铜.
为测定氨分子中氮、氢原子个数比,某研究性学习小组用浓氨水和氧化钙反应制取氨气,然后用氨气与氧化铜粉末发生氧化还原反应.设计了如下实验流程:实验中,先检查装置气密性;然后用制得的氨气排尽洗气瓶前所有装置中的空气;再连接洗气瓶和气体测量装置;立即加热氧化铜.反应完成后,黑色的氧化铜转化为红色的铜.
