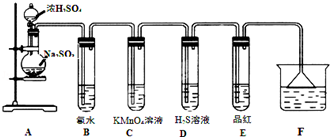
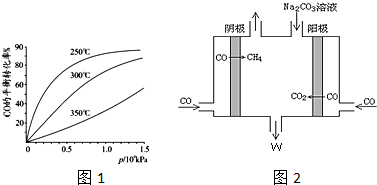
题目内容
16.下列关于溶液和胶体的叙述,正确的是( )| A. | 溶液是电中性的,胶体是带电的 | |
| B. | 向饱和FeCl3溶液中滴加过量氨水,可制取Fe(OH)3胶体 | |
| C. | 葡萄糖注射液能产生丁达尔效应,属于胶体 | |
| D. | 一束光线分别通过溶液和胶体时,后者会出现明显的光带,前者则没有 |
分析 胶体是分散系的一种,胶体不带电,但是能够吸附带电离子形成胶体微粒,胶体具有丁达尔效应、电泳、聚沉等性质,据此解答.
解答 解:A.胶体本身不带电,但是能够吸附带电离子形成胶体微粒,故A错误;
B.氯化铁与氨水发生复分解反应生成氢氧化铁沉淀,得不到胶体,故B错误;
C.溶液不具有丁达尔效应,故C错误;
D.胶体具有丁达尔效应,当一束光线分别通过胶体时,会出现明显的光带,丁达尔效应是胶体特有的性质,常用来鉴别胶体和溶液,故D正确;
故选D.
点评 本题考查胶体的性质,明确胶体常见的性质有丁达尔现象、胶体的聚沉、电泳等是解题关键,题目难度不大.

练习册系列答案
相关题目
7.某温度下,浓度都是1mol•L-1的两种气体X2和Y2,在密闭容器中反应生成气体Z,经过t min后,测得各物质的浓度分别为c(X2)=0.4mol•L-1,c(Y2)=0.6mol•L-1,c(Z)=0.4mol•L-1,则该反应的化学方程式可表示为( )
| A. | 2X2+3Y2?2X2Y3 | B. | 3X2+2Y2?2X3Y2 | C. | X2+2Y2?XY2 | D. | 2X2+Y2?2X2Y |
4.常温下,下列溶液可以用铁罐车装运的是( )
| A. | 氢氧化钠溶液 | B. | 浓硫酸 | C. | 浓盐酸 | D. | 稀硝酸 |
5.化学与生产、生活密切相关,下列叙述错误的是( )
| A. | 饱和Na2SO4溶液可以使蛋白质变性 | |
| B. | 大力推广应用“脱硫、脱硝”技术,可减少硫氧化物、氮氧化物对空气的污染 | |
| C. | 从海带中提取碘单质的过程涉及氧化还原反应 | |
| D. | 镀锌铁桶镀层破损后铁仍不易被腐蚀 |
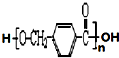
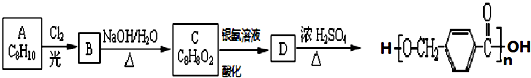
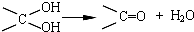
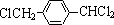 ,其中的官能团名称为氯原子.
,其中的官能团名称为氯原子.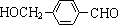 +2Ag(NH3)2OH $\stackrel{△}{→}$
+2Ag(NH3)2OH $\stackrel{△}{→}$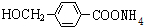 +2Ag↓+3NH3+H2O,由D生成高分子化合物的反应n
+2Ag↓+3NH3+H2O,由D生成高分子化合物的反应n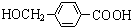 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$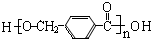 +(n-1)H2O
+(n-1)H2O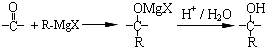
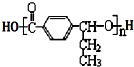 在合成过程中所用的格氏试剂的化学式为CH3CH2MgX(用X表示卤原子),合成过程中涉及到的有机化学反应类型有ACD(填编号)
在合成过程中所用的格氏试剂的化学式为CH3CH2MgX(用X表示卤原子),合成过程中涉及到的有机化学反应类型有ACD(填编号)