题目内容
设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A、1L 1mol?L-1的NaClO溶液中含ClO-的数目为NA |
| B、78 g 苯含有碳碳双键的数目为3NA |
| C、12.0g熔融的NaHSO4中含有的阳离子数为0.2NA |
| D、苯和苯甲酸混合物1 mol,完全燃烧消耗O2的分子数为7.5NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.醋酸钠溶液中,次氯酸根离子部分水解,导致溶液中次氯酸根离子数目减少;
B.苯分子中的碳碳键为介于单键和双键之间的独特键,不存在碳碳双键;
C.熔融硫酸氢钠电离出钠离子和硫酸氢根离子,12g硫酸氢钠的物质的量为0.1mol,含有的阳离子为0.1mol;
D.1mol苯或苯甲酸完全燃烧都消耗7.5mol氧气,所以1mol二者的混合物完全燃烧消耗7.5mol氧气.
B.苯分子中的碳碳键为介于单键和双键之间的独特键,不存在碳碳双键;
C.熔融硫酸氢钠电离出钠离子和硫酸氢根离子,12g硫酸氢钠的物质的量为0.1mol,含有的阳离子为0.1mol;
D.1mol苯或苯甲酸完全燃烧都消耗7.5mol氧气,所以1mol二者的混合物完全燃烧消耗7.5mol氧气.
解答:
解:A.1L 1mol?L-1的NaClO溶液中含有溶质次氯酸钠1mol,由于次氯酸根离子部分水解,溶液中含有的次氯酸根离子小于1mol,含ClO-的数目小于NA,故A错误;
B.78g苯的物质的量为1mol,由于苯分子中的碳碳键为一种独特键,其分子中不存在碳碳双键,故B错误;
C.12.0g熔融硫酸氢钠的物质的量为0.1mol,0.1mol硫酸氢钠电离出0.1mol钠离子和0.1mol硫酸氢根离子,含有的阳离子数为0.1NA,故C错误;
D.苯甲酸可以看成C6H6?CO2,它完全燃烧的时跟苯C6H6的耗氧量相同,所以苯和苯甲酸混合物1 mol,完全燃烧消耗7.5molO2,消耗O2的分子数为7.5NA,故D正确;
故选D.
B.78g苯的物质的量为1mol,由于苯分子中的碳碳键为一种独特键,其分子中不存在碳碳双键,故B错误;
C.12.0g熔融硫酸氢钠的物质的量为0.1mol,0.1mol硫酸氢钠电离出0.1mol钠离子和0.1mol硫酸氢根离子,含有的阳离子数为0.1NA,故C错误;
D.苯甲酸可以看成C6H6?CO2,它完全燃烧的时跟苯C6H6的耗氧量相同,所以苯和苯甲酸混合物1 mol,完全燃烧消耗7.5molO2,消耗O2的分子数为7.5NA,故D正确;
故选D.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意明确苯分子中碳碳键情况,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,选项C为易错点,注意熔融硫酸氢钠中含有的阳离子为钠离子.

练习册系列答案
相关题目
现有A、B、C、D四种金属片,进行如下的实验:①将A、B用金属导线连接后同时浸入稀硫酸中,A上有气泡产生;②C、D用金属导线连接后同时浸入稀硫酸中,电子流动的方向为:D→导线→C;③把A、D用金属导线连接后同时浸入稀硫酸中,D上发生还原反应.根据上述实验,四中金属的活动顺序正确的是( )
| A、A>B>C>D |
| B、C>B>A>D |
| C、B>A>D>C |
| D、D>C>A>B |
在铜锌电池中,下列叙述正确的是( )
| A、正极附近硫酸根离子浓度增大 |
| B、负极附近硫酸根离子浓度减小 |
| C、正极附近硫酸根离子浓度减小 |
| D、若锌片、铜片同时有气泡冒出,说明锌不纯 |
下列有关环境问题与NO2无关的是( )
| A、酸雨 | B、温室效应 |
| C、臭氧层空洞 | D、光化学烟雾 |
下列与化学反应能量变化相关的叙述正确的是( )
| A、生成物能量一定低于反应物总能量 |
| B、相同条件下,2mol氢原子所具有的能量小于1mol氢分子所具有的能量 |
| C、根据盖斯定律,可计算某些难以直接测定的化学反应的反应焓变 |
| D、同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件的△H不同 |
关于加碘食盐,下列说法错误的是( )
| A、密封,防潮和避光保存 |
| B、加碘食盐即加入了少量单质碘的食盐 |
| C、菜炒熟出锅时,再加碘盐 |
| D、多加点醋,可以提高碘的利用率 |
对下列有机反应类型的认识中,不正确的是( )
A、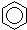 +HNO3 +HNO3
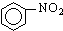 +H2O;取代反应 +H2O;取代反应 | |||
| B、CH4+Cl2→CH3Cl+HCl;置换反应 | |||
C、CH2═CH2+H2O
| |||
D、2CH3CH2OH+O2
|
有甲酸、乙酸、乙醛、乙酸乙酯、乙醇、溴乙烷6种无色溶液,只用一种试剂就可以将它们一一鉴别出来.这种试剂是( )
| A、蒸馏水 |
| B、FeCl3溶液 |
| C、新制Cu(OH)2悬浊液 |
| D、NaOH溶液 |
 纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域.
纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域.