题目内容
5.(1)写出下列化合物的结构简式2,2,3,3,-四甲基戊烷:(CH3)3C-C(CH3)2-CH2-CH3.(2)①写出Na2CO3溶液与AlCl3溶液反应的离子方程3CO32-+2Al3++3H2O=2Al(OH)3↓+3CO2↑.
②写出由甲苯制备TNT的化学方程式:
 .
.③Na2CO3溶液显碱性,用离子方程式表示原因CO32-+H2O?HCO3-+OH-,其溶液中离子浓度大小顺序为c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+).
(3)除去括号中的杂质,填上适宜的试剂和提纯方法乙醇(水):CaO、蒸馏.
甲烷燃料电池(在KOH环境中)的负极的电极反应式:CH4+10OH--8e-=CO32-+7H2O.
(4)将煤转化为煤气的主要化学反应为:C(s)+H2O(g)═CO(g)+H2(g)
C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-242.0kJ/mol
CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0kJ/mol
根据以上数据,写出C(s)与水蒸气反应的热化学方程C(s)+H2O(g)═CO(g)+H2(g)△H=+131.5kJ•mol-1.
分析 (1)是主链有5个碳原子的烷烃,2号、3号碳上各有2个甲基;
(2))①Na2CO3溶液与AlCl3溶液反应发生双水解;
②甲苯在浓硫酸作用下可与浓硝酸反应生成TNT;
③Na2CO3溶液显碱性是由于CO32-能水解,根据碳酸钠在溶液中的行为来分析;
(3)除去乙醇中的水的方法是加生石灰然后蒸馏即可;
KOH溶液做电解质,甲烷在负极失电子发生氧化反应在碱溶液中生成碳酸盐;
(4)根据盖斯定律,将所给的反应通过加减乘除等变形得所要求的目标反应,反应热做相应的变化即可.
解答 解:(1)2,2,3,3-四甲基戊烷,主链有5个碳原子,2号、3号碳上各有2个甲基,结构简式为:(CH3)3C-C(CH3)2-CH2-CH3,
故答案为:(CH3)3C-C(CH3)2-CH2-CH3;
(2)①Na2CO3溶液与AlCl3溶液反应发生双水解:3CO32-+2Al3++3H2O=2Al(OH)3↓+3CO2↑,故答案为:3CO32-+2Al3++3H2O=2Al(OH)3↓+3CO2↑;
②甲苯在浓硫酸作用下可与浓硝酸反应生成TNT,反应的化学方程式为 ,
,
故答案为: ;
;
③Na2CO3溶液显碱性是由于CO32-能水解:CO32-+H2O?HCO3-+OH-;在Na2CO3溶液中Na2CO3═2Na++CO32-,CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-,CO32-水解使溶液呈碱性,有c(OH-)>c(H+);由于CO3-少部分水解,有c(CO32-)>c(HCO3-),H CO3-又发生第二步水解,有c(OH-)>c(HCO3-),第二步水解较第一步水解弱的多,那么c(OH-)、c(H CO3-)相差不大,但c(H+)比c(OH-)小的多,因此c(OH-)>c(HCO3-),溶液中离子浓度大小为:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+),
故答案为:CO32-+H2O?HCO3-+OH-;c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+);
(3)除去乙醇中的水的方法是加生石灰CaO,将水反应为Ca(OH)2,然后蒸馏即可得无水乙醇.
KOH溶液做电解质,氧气在正极得到电子生成氢氧根离子,则正极为2O2+4H2O+8e-=8OH-,甲烷失电子在碱溶液中反应,甲烷在负极失电子发生氧化反应在碱溶液中生成碳酸盐,此时不会有CO2放出;负极为CH4+10OH--8e-=CO32-+7H2O;故答案为:CaO,蒸馏;CH4+10OH--8e-=CO32-+7H2O;
(4)①C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol
②H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-242.0kJ/mol
③CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0kJ/mol
根据盖斯定律,将①-②-③可得:C(s)+H2O(g)═CO(g)+H2(g)△H=+131.5 kJ/mol,
故答案为:C(s)+H2O(g)═CO(g)+H2(g)△H=+131.5 kJ/mol;
点评 本题综合考查了原电池的电极反应、离子方程式的书写和盐类的水解等以及盖斯定律,明确在离子反应中哪些物质应保留化学式及反应的实质是解答本题的关键,难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | X2+是XO4-的还原产物 | |
| B. | 溶液中可发生:Z2+2A2+═2A3++2Z- | |
| C. | 氧化性强弱的顺序为:XO4->B2>Z2>A3+ | |
| D. | Z2在①中是氧化产物,③中是氧化剂 |
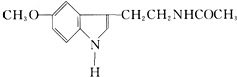
| A. | 它属于芳香族化合物 | B. | 它属于高分子化合物 | ||
| C. | 分子式为C13N2H16O2 | D. | 在一定条件下可以发生加成反应 |
| A. | 1.6 mol SO2+0.3 mol O2+0.4 mol SO3 | |
| B. | 2.0 mol SO2+1.0 mol O2+2.0 mol SO3 | |
| C. | 3.0 mol SO2+0.5 mol O2+1.0 mol SO3 | |
| D. | 3.0 mol SO2+1.0 mol O2+1.0 mol SO3 |
| A. | 在FeCl3溶液中加入NaOH溶液 | B. | 加热煮沸FeCl3溶液 | ||
| C. | 把FeCl3溶液滴入沸水中 | D. | 把饱和的FeCl3溶液滴入到沸水中 |