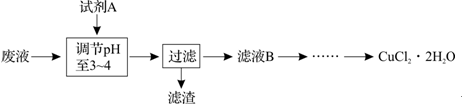
题目内容
下列离子方程式书写正确的是( )
| A、石灰水中通入少量CO2:Ca2++2OH-+CO2=CaCO3↓+H2O |
| B、稀 H2SO4与铁粉反应:2Fe+6H+=2Fe3++3H2↑ |
| C、将金属钠加入水中:Na+2H2O=Na++2OH-+H2↑ |
| D、碳酸钙与盐酸反应:CO32-+2H+=H2O+CO2↑ |
考点:离子方程式的书写
专题:
分析:A.氢氧化钙与少量二氧化碳反应生成碳酸钙和水;
B.不符合反应的客观事实;
C.电荷不守恒;
D.碳酸钙为沉淀,应保留化学式.
B.不符合反应的客观事实;
C.电荷不守恒;
D.碳酸钙为沉淀,应保留化学式.
解答:
解:A.石灰水中通入少量CO2,离子方程式:Ca2++2OH-+CO2=CaCO3↓+H2O,故A正确;
B.稀 H2SO4与铁粉反应,离子方程式:Fe+2H+=Fe2++H2↑,故B错误;
C.将金属钠加入水中,离子方程式:2Na+2H2O=2Na++2OH-+H2↑故C错误;
D.碳酸钙与盐酸反应,离子方程式为:CaCO3+2H+=H2O+CO2↑+Ca2+,故D错误;
故选:A.
B.稀 H2SO4与铁粉反应,离子方程式:Fe+2H+=Fe2++H2↑,故B错误;
C.将金属钠加入水中,离子方程式:2Na+2H2O=2Na++2OH-+H2↑故C错误;
D.碳酸钙与盐酸反应,离子方程式为:CaCO3+2H+=H2O+CO2↑+Ca2+,故D错误;
故选:A.
点评:本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,注意离子方程式遵循质量守恒定律、电荷数守恒定律.

练习册系列答案
相关题目
在强酸性的无色溶液中能大量共存的离子组是( )
| A、NH4+、Mg2+、SO42-、Cl- |
| B、Ba2+、K+、OH-、NO3- |
| C、Al3+、Cu2+、SO42-、Cl- |
| D、Na+、Ca2+、Cl-、HCO3- |
下列关于氯的说法正确的是( )
| A、35Cl的质量数为35,所以氯元素的相对原子质量为35 |
| B、35Cl和37Cl为不同的核素,有不同的化学性质 |
| C、实验室制备氯气可以用排饱和食盐水的方法集气收集 |
| D、1.12LCl2含有1.7NA个质子(NA表示阿伏加德罗常数) |
下列各组分子中,都属于含极性键的非极性分子的是( )
| A、CO2 H2S |
| B、BF3 CH4 |
| C、C60 C2H4 |
| D、NH3 HCl |
常温下,将0.02mol?L-1的Ba(OH)2溶液100mL和0.02mol?L-1的NaHSO4溶液100mL混合,若忽略溶液体积变化,则混合后的溶液( )
| A、由水电离产生的c(H+)=1.0×10-2 mol?L-1 |
| B、pH=12 |
| C、pH=2 |
| D、混合后的溶液溶质的物质的量浓度为0.02 mol?L-1 |