题目内容
16.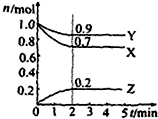 某温度时在2L容器中X、Y、Z三种物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析:
某温度时在2L容器中X、Y、Z三种物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析:(1)该反应的化学方程式为:3X+Y?2Z;
(2)反应开始至2min,用Z表示的平均反应速率为:0.05mol/(L•min);
(3)下列叙述能说明上述反应达到化学平衡状态的是AB(填序号).
A.各物质的浓度不随时间的变化而变化
B.单位时间内每消耗3mol X,同时生成3mol X
C.X,Y,Z的浓度之比为1:1:1
D.反应已经停止
(4)在密闭容器里,通入a mol X(g)和b mol Y(g),发生反应X(g)+Y(g)═2Z(g),当改变下列条件时,反应速率会发生什么变化?(选填“增大”、“减小”或“不变”)
①在其它条件不变时 降低温度:减小;
②在其它条件不变时加入催化剂:增大.
分析 (1)根据物质的量的变化判断反应物和生成物,根据物质的量的变化之比等于化学计量数之比书写方程式;
(2)分析图象计算Z的消耗物质的量为0.2mol,结合反应速率概念计算,V=$\frac{△c}{△t}$;
(3)A.各物质的浓度不随时间的变化而变化,说明反应达平衡状态;
B.单位时间内每消耗3mol X,同时生成3mol X,说明正逆反应速率相等,反应达平衡状态;
C.达平衡状态时,X,Y,Z的浓度之比可能为1:1:1,也可能不是与各物质的起始浓度和转化率有关;
D.化学平衡状态是动态平衡;
(4)①在其它条件不变时 降低温度反应速率减小;
②在其它条件不变时加入催化剂加快化学反应速率.
解答 解:(1)由图象可以看出,反应中X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成物,且△n(X):△n(Y):△n(Z)=0.3mol:0.1mol:0.2mol=3:1:2,则反应的化学方程式为:3X+Y?2Z,
故答案为:3X+Y?2Z;
(2)图象计算Z的消耗物质的量为0.2mol,从开始至2min,Z的平均反应速率=$\frac{\frac{0.2mol}{2L}}{2min}$=0.05mol/(L•min);
故答案为:0.05mol/(L•min);
(3)A.各物质的浓度不随时间的变化而变化,说明反应达平衡状态,故正确;
B.单位时间内每消耗3mol X,同时生成3mol X,说明正逆反应速率相等,反应达平衡状态,故正确;
C.达平衡状态时,X,Y,Z的浓度之比可能为1:1:1,也可能不是与各物质的起始浓度和转化率有关,故错误;
D.化学平衡状态是动态平衡,不可能停止,故错误;故选:AB;
(4)①在其它条件不变时 降低温度反应速率减小,故答案为:减小;
②在其它条件不变时加入催化剂加快化学反应速率,故答案为:增大.
点评 本题考查了化学反应速率、化学平衡状态判断,主要是概念的计算应用,掌握基础是解题关键,题目较简单.

 全优点练单元计划系列答案
全优点练单元计划系列答案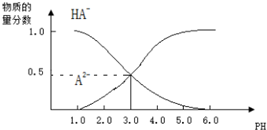
| A. | H2A的电离方程式为:H2A?H++HA-,HA-?H++A2- | |
| B. | 0.1mol/LNaHA溶液中存在c(A2-)+c(HA-)+c(H2A)=0.1mol/L | |
| C. | 常温下,等物质的量浓度的NaHA与Na2A溶液等体积混合后溶液pH=3.0 | |
| D. | pH=4.0时,图中n(HA-)约为0.0091mol |
| A. | 纯碱溶液显碱性:CO32-+2H2O?H2CO3+2OH- | |
| B. | 醋酸溶液显酸性:CH3COOH+H2O?CH3COO-+H3O+ | |
| C. | 向碘化亚铁溶液中通入足量的溴水:3Br2+2Fe2++4I-═6Br-+2Fe3++2I2 | |
| D. | 向碳酸氢钙溶液中滴加过量的烧碱溶液:HCO3-+Ca2++2OH-═CaCO3↓+H2O |
| A. | 0.2Q | B. | 10Q | C. | 5Q | D. | 0.1Q |
| A. | 在pH=1的溶液中:NH4+、ClO-、Cl- | |
| B. | 有SiO32-存在的溶液中:Na+、SO42-、Cl- | |
| C. | 有NO3-存在的溶液中:H+、Ba2+、Fe2+ | |
| D. | 室温下,水电离的c水(H+)=1.0×10-13mol•L-1溶液中:Na+、S2-、AlO2- |
| A. | 聚乙烯、聚氯乙烯、纤维素都属于合成高分子 | |
| B. | 油脂、淀粉和蛋白质都是食物中含有的重要营养物质,一定条件下都能水解 | |
| C. | 除去乙酸乙酯中的少量乙酸,可加入氢氧化钠溶液充分反应后分液 | |
| D. | 丙烷的同分异构体共有3种 |

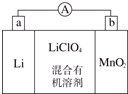 锂锰电池的体积小、性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4,溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2. 回答下列问题:
锂锰电池的体积小、性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4,溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2. 回答下列问题: