题目内容
MnO2可与KOH和KClO3在高温条件下反应,生成K2MnO4,反应的离子方程式为: .
考点:离子方程式的书写
专题:离子反应专题
分析:反应中化合价变化的元素为Mn、Cl,Mn元素由+4价升高为+6,Cl元素化合价由+5降低为-1,根据化合价升降相等,则二氧化锰与氯酸钾的物质的量之比为3:1,再根据原子守恒配平,写出反应的离子方程式.
解答:
解:二氧化锰与KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl,反应中化合价变化的元素为Mn、Cl,Mn元素由+4价升高为+6,Cl元素化合价由+5降低为-1,根据化合价升降相等,则二氧化锰与氯酸钾的物质的量之比为3:1,再根据原子守恒配平方程式为:3MnO2+6KOH+KClO3
3K2MnO4+KCl+3H2O,改写成离子方程式为:3MnO2+6OH-+ClO3-
3MnO42-+Cl-+3H2O,
故答案为:3MnO2+6OH-+ClO3-
3MnO42-+Cl-+3H2O.
| ||
| ||
故答案为:3MnO2+6OH-+ClO3-
| ||
点评:本题考查了离子方程式的书写、氧化还原反应的配平,题目难度中等,注意掌握氧化还原反应的配平方法,明确离子方程式的书写原则.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列措施能减慢化学反应速率的是( )
| A、将煤块粉碎后燃烧 |
| B、将食物贮藏在冰箱中 |
| C、用氯酸钾制氧气时添加二氧化锰粉末作催化剂 |
| D、用粗锌替代纯锌与同浓度同体积的盐酸反应制氢气 |
下列说法中错误的是( )
| A、同一元素的各种同位素的化学性质相似 |
| B、元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素 |
| C、除氦外的稀有气体原子的最外层电子数都是8 |
| D、原子及其离子的核外电子层数等于该元素所在的周期数 |
设NA为阿伏加德罗常数的数值,下列叙述正确的是(相对原子量:H-1 C-12)( )
| A、1 mol/L氯化铜溶液中的Cu2+数小于NA |
| B、标准状况下,22.4 L Cl2参加任何化学反应转移的电子数都是2NA |
| C、常温常压下,16g氧气和16g臭氧(O3)所含有的氧原子数均为NA |
| D、1 mol CH5+所含电子数为8NA |
下列离子方程式正确的是( )
| A、碳酸钙与盐酸反应:CaCO3+2H+═Ca2++H2O+CO2↑ |
| B、锌与盐酸反应:Zn+2H++2Cl-═Zn2++2Cl-+H2↑ |
| C、氯化铁与氢氧化钡溶液反应:2Fe3++3Ba(OH)2═2Fe(OH)3↓+3Ba2+ |
| D、氢氧化铜与硫酸反应:OH-+H+═H2O |
能正确表示下列反应的离子方程式为( )
| A、硫化亚铁溶于稀硝酸中:FeS+2H+=Fe2++H2S↑ |
| B、NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-=CO32-+H2O |
| C、碳酸钙溶于稀盐酸中CaCO3+2H+=Ca2++H2O+CO2↑ |
| D、将铁粉加入稀硫酸中:2Fe+6H+=2Fe3++3H2↑ |
下列叙述中正确的是( )
| A、VSEPR模型就是分子的空间构型 |
| B、在共价化合物分子中一定存在σ键 |
| C、全由非金属元素组成的化合物一定是共价化合物 |
| D、共价键键长越短,键能一定越大 |
某化学反应2X(g)?Y(g)+Z(g)在4种不同条件下进行,Y、Z起始浓度为0,反应物X的浓度(mol?L-1)随反应时间(min)的变化情况如下表:
下列说法不正确的是( )
| 实验 序号 | 时间 浓度 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | C | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
| A、C>1.0 |
| B、实验2可能使用了催化剂 |
| C、实验3比实验2先达到化学平衡状态 |
| D、前10分钟,实验4的平均化学反应速率比实验1的大 |
高温下,超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为-2价.如图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元),则下列说法中正确的是( )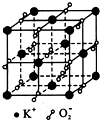

| A、超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个O2- |
| B、晶体中每个K+周围有8个O2-,每个O2-周围有8个K+ |
| C、晶体中与每个K+距离最近的K+有8个 |
| D、晶体中,0价氧原子与-2价氧原子的数目比为1:1 |