题目内容
用98%的浓硫酸(密度为1.84g/cm3)配制100mL 1mol/L的稀硫酸,现给出下列仪器(配制过程中可能用到):①100mL量筒 ②10mL量筒 ③50mL烧杯 ④电子天平 ⑤100mL容量瓶 ⑥胶头滴管 ⑦玻璃棒,配制中所需仪器的正确的是( )
| A、②③⑤⑥⑦ | B、②⑤⑦⑥ |
| C、①③⑤⑥⑦ | D、③④⑤⑥⑦ |
考点:配制一定物质的量浓度的溶液
专题:物质的量浓度和溶解度专题
分析:先计算出浓硫酸的物质的量浓度为c=
,然后根据溶液稀释定律C浓V浓=C稀V稀来计算需要的浓硫酸的体积;
根据配制步骤是计算、量取、稀释、移液、洗涤、定容、摇匀、装瓶来分析需要的仪器以及使用的先后顺序.
| 1000ρω |
| M |
根据配制步骤是计算、量取、稀释、移液、洗涤、定容、摇匀、装瓶来分析需要的仪器以及使用的先后顺序.
解答:
解:浓硫酸的物质的量浓度为c=
=
=18.4mol/L,设需要的浓硫酸的体积为XmL,根据溶液稀释定律C浓V浓=C稀V稀可知:
18.4mol/L×VmL=1mol/L×100mL
解得V=5.4mL,故应选用10mL的量筒.
操作步骤有计算、量取、稀释、洗涤、定容、摇匀、装瓶等操作,一般用10mL量筒量取浓硫酸,在烧杯中稀释(可用量筒量取水加入烧杯),并用玻璃棒搅拌.冷却后转移到100mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2-3次,并将洗涤液移入容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀,故所使用的仪器以及先后顺序是:②③⑤⑥⑦,
故选A.
| 1000ρω |
| M |
| 1000×1.84g/ml×98% |
| 98g/mol |
18.4mol/L×VmL=1mol/L×100mL
解得V=5.4mL,故应选用10mL的量筒.
操作步骤有计算、量取、稀释、洗涤、定容、摇匀、装瓶等操作,一般用10mL量筒量取浓硫酸,在烧杯中稀释(可用量筒量取水加入烧杯),并用玻璃棒搅拌.冷却后转移到100mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2-3次,并将洗涤液移入容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀,故所使用的仪器以及先后顺序是:②③⑤⑥⑦,
故选A.
点评:本题考查了一定物质的量浓度的溶液的配制的过程中仪器的使用顺序,难度不大,掌握配制步骤是关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
在密闭容器中,发生反应:xA(g)+yB(g)?zC(g).反应达到平衡时,A的浓度为0.5mol/L;若保持温度不变,将容器的容积扩大到原来的2倍,达到新平衡时A的浓度降为0.3mol/L.下列判断正确的是( )
| A、x+y<z |
| B、平衡向正反应方向移动 |
| C、B的转化率升高 |
| D、C的体积分数下降 |
分子式为C3H6Cl2的有机物,发生一元氯代反应后,可以生成两种同分异构体,则原C3H6Cl2的名称是( )
| A、1,2-二氯丙烷 |
| B、1,1-二氯丙烷 |
| C、1,3-二氯丙烷 |
| D、2,2-二氯丙烷 |
由Fe2O3、Fe、CuO、C、Al中的几种物质组成的混合粉末,取样品进行下列实验(部分产物略去).关于混合粉末的组成判断正确的是( )


| A、一定含CuO和C |
| B、一定含Fe2O3、CuO和C |
| C、一定含CuO和C,一定不含Al |
| D、不管试剂a为H2O或饱和NaHCO3溶液,气体Z都为纯净物 |
下列物质不能用于鉴别乙醇和乙醛的是( )
| A、新制氢氧化铜悬浊液 |
| B、氢氧化钠溶液 |
| C、金属钠 |
| D、银氨溶液 |
下列溶液与100mL0.5mol/LNa2SO4溶液中的 Na+的物质的量浓度相等的是( )
| A、200mL0.5mol/LNaCl溶液 |
| B、100mL1mol/LNa2CO3溶液 |
| C、100mL0.5mol/LNa3PO4溶液 |
| D、1L1mol/LNaOH溶液 |
 )和C.经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生.
)和C.经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生.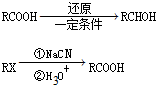
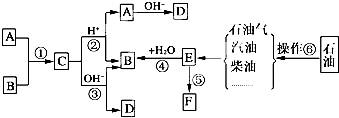
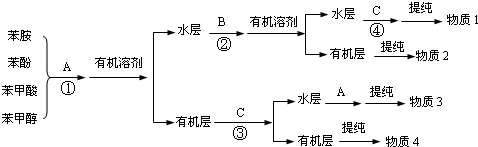
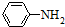 )有弱碱性,可与盐酸等反应生成盐;
)有弱碱性,可与盐酸等反应生成盐;