题目内容
2.根据下列氧化还原反应回答下列问题:3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O
(1)用双线桥标出电子转移的方向和数目
(2)HNO3在反应中体现了什么性质?
(3)氧化剂与氧化产物的物质的量比是2:3.
(4)当有96g Cu被氧化时,生成的NO在标况下的体积为22.4L,反应中转移的电子物质的量为3 mol.
分析 (1)8HNO3(稀)+3Cu=3Cu(NO3)2+2NO↑+4H2O中,Cu元素的化合价由0升高为+2价,N元素的化合价由+5价降低为+2价,以此来解答;
(2)HNO3在反应中起氧化剂作用的硝酸与起酸性作用;
(3)氧化剂是2mol的硝酸与氧化产物是3mol的硝酸铜;
(4)96g Cu的物质的量为:$\frac{96g}{64g/mol}$=1.5mol,所以生成的NO在标况下的体积为$\frac{1.5×2}{3}×22.4$=22.4L,反应中转移电子的物质的量为1.5mol×2=3mol,由此解答.
解答 解:(1)Cu元素的化合价由0升高为+2价,N元素的化合价由+5价降低为+2价,则用双线桥标明电子转移的方向和数目为 ,
,
故答案为: ;
;
(2)HNO3在反应中起氧化剂作用的硝酸与起酸性作用,故答案为:氧化性和酸性;
(3)氧化剂是2mol的硝酸与氧化产物是3mol的硝酸铜,所以氧化剂与氧化产物的物质的量比是2:3,故答案为:2:3;
(4)96g Cu的物质的量为:$\frac{96g}{64g/mol}$=1.5mol,所以生成的NO在标况下的体积为$\frac{1.5×2}{3}×22.4$=22.4L,反应中转移电子的物质的量为1.5mol×2=3mol,故答案为:22.4L;3mol.
点评 本题考查氧化还原反应,为高考常见考点,明确反应中元素的化合价变化是解答的关键,侧重基本概念和转移电子数的考查,题目难度不大.

练习册系列答案
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案
相关题目
12.化学无处不在,下列与化学相关的说法不正确的是( )
| A. | 碘是人体必需微量元素,所以应多吃富含高碘酸的食物 | |
| B. | “血液透析”运用了胶体的性质 | |
| C. | 过氧化钠可作为高空飞行或潜水装置中的供氧剂 | |
| D. | 大力开发太阳能、风能、水能等新能源,减少煤、石油等化石燃料的使用,有利于实现“低碳经济” |
13.下列说法不正确的是( )
| A. | 2014年西非国家爆发埃博拉病毒,双氧水、高锰酸钾溶液可以完全灭活该病毒感染性,其消毒原理和漂白粉消毒饮用水相同 | |
| B. | 2015年初公益调查《柴静雾霾调查:穹顶之下》发布,引起社会强烈反响.雾霾中PM2.5属于胶体 | |
| C. | 容量瓶、量筒和滴定管上都标有使用温度,量筒、容量瓶无“0”刻度,滴定管有“0”刻度;使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗 | |
| D. | 汽油、煤油、植物油都是油,但它们的主要成分不相同 |
11.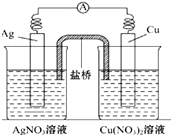 用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U形管)构成一个原电池如图所示.以下有关该原电池的叙述正确的是( )
用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U形管)构成一个原电池如图所示.以下有关该原电池的叙述正确的是( )
 用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U形管)构成一个原电池如图所示.以下有关该原电池的叙述正确的是( )
用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U形管)构成一个原电池如图所示.以下有关该原电池的叙述正确的是( )| A. | 在外电路中,电流由铜电极流向银电极 | |
| B. | 该装置是将电能转化为化学能 | |
| C. | 实验过程中取出盐桥,原电池仍继续工作 | |
| D. | 正极反应为:Ag++e-═Ag |
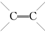 的化合物与CH2═CH2一样,在一定条件下可聚合成高分子化合物.
的化合物与CH2═CH2一样,在一定条件下可聚合成高分子化合物.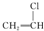 聚合而成的,其化学方程式是
聚合而成的,其化学方程式是 .
.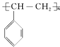 ),它是由
),它是由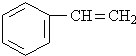 (写结构简式)聚合而成的.
(写结构简式)聚合而成的. ;
;