题目内容
14.将NaHCO3和部分风化的纯碱晶体组成的混合物样品m g配成250mL的溶液,取25mL上述溶液加入1.0mol/L盐酸至恰好完全反应时,用去盐酸30.0mL.若将上述样品m g加热至质量不变时,可得到固体的质量为( )| A. | 10.6g | B. | 12.6g | ||
| C. | 15.9g | D. | 数据不足,无法确定 |
分析 n(HCl)=1.0mol/L×0.03L=0.03mol,碳酸氢钠和纯碱晶体与稀盐酸反应都生成NaCl,根据Na、Cl原子守恒得25mL溶液中n(Na+)=n(NaCl)=n(HCl)=0.03mol,250mL碳酸钠和纯碱晶体混合溶液中n(Na+)=0.03mol×10=0.3mol,若将上述样品m g加热至质量不变时,剩余固体是碳酸钠,根据Na原子守恒计算碳酸钠质量.
解答 解:n(HCl)=1.0mol/L×0.03L=0.03mol,碳酸氢钠和纯碱晶体与稀盐酸反应都生成NaCl,根据Na、Cl原子守恒得25mL溶液中n(Na+)=n(NaCl)=n(HCl)=0.03mol,250mL碳酸钠和纯碱晶体混合溶液中n(Na+)=0.03mol×10=0.3mol,若将上述样品m g加热至质量不变时,剩余固体是碳酸钠,根据Na原子守恒得n(Na2CO3)=$\frac{1}{2}$n(Na+)=$\frac{1}{2}$×0.3mol=0.15mol,m(Na2CO3)=0.15mol×106g/mol=15.9g,故选C.
点评 本题考查化学方程式有关计算,为高频考点,侧重考查学生分析计算能力,正确利用原子守恒是解本题关键,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.短周期主族元素X、Y、Z、W的原子序数依次增大,其中元素X的原子最外层电子数是其电子层数的2倍,元素Y在同周期的主族元素中原子半径最大,元素Z是地壳中含量最高的金属元素,W的单质是一种淡黄色固体.下列说法正确的是( )
| A. | X、Y均只有1种氧化物 | |
| B. | 原子半径:X<Y<Z | |
| C. | 简单气态氢化物的热稳定性:X>W | |
| D. | Y、Z、W的最高价氧化物的水化物能相互反应 |
2.下列反应中,放出气体的物质的量最多的是( )
| A. | 0.1mol Fe与足量的盐酸反应 | B. | 0.4mol Cu投入到足量的稀硫酸中 | ||
| C. | 0.1mol Al与足量的NaOH溶液反应 | D. | 0.1mol Fe与足量的水反应 |
9.下列离子方程式中正确的是( )
| A. | 铁与稀硝酸反应:Fe+2H+=Fe2++H2 | |
| B. | 氯化钡溶液中通入足量CO2:Ba2++CO2+H2O=BaCO3↓+2H+ | |
| C. | 碳酸氢钙溶液与盐酸反应:HCO3-+H+=CO2↑+H2O | |
| D. | 澄清石灰水中滴入少量的NaHCO3溶液:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O |
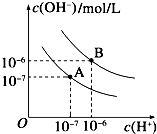 已知水在25℃和95℃时的电离平衡曲线如下图所示:
已知水在25℃和95℃时的电离平衡曲线如下图所示:
 某研究小组为了探究“铁与水蒸气”能否发生反应及反应的产物,进行了下列实验:用如图所示实验装置,在硬质玻璃管B中放入铁粉和石棉绒的混合物,再结合一些步骤,就可以完成髙温下“Fe与水蒸气的反应实验”(己知石棉绒是耐高温材料,不与水和铁反应).
某研究小组为了探究“铁与水蒸气”能否发生反应及反应的产物,进行了下列实验:用如图所示实验装置,在硬质玻璃管B中放入铁粉和石棉绒的混合物,再结合一些步骤,就可以完成髙温下“Fe与水蒸气的反应实验”(己知石棉绒是耐高温材料,不与水和铁反应).