题目内容
2.在2L的密闭容器中加入2mol A和1mol B,发生反应:2A(g)+B(g)?2C(g)+D(s)达到平衡时,C的浓度为0.4mol•L-1.(1)温度不变,若缩小容器的体积,则平衡正向移动(填正向、逆向或不)
(2)其他条件不变,使用催化剂,正反应速率将加快(填“加快”、“减慢”或“不变”,下同),逆反应速率将加快.A的转化率将不变(填“增大”、“减小”或“不变”).
(3)维持容器的温度和体积不变,按下列四种配比作为起始物质,达到平衡后,C的浓度仍是0.4mol•L-1的是BD.
A、4molA+2molB B、2molC+1molD
C、2molA+1molB+2molC+1molD D、1molA+0.5molB+1molC+0.2molD.
分析 (1)缩小体积相当于增大压强,平衡向气体体积减少的方向移动;
(2)其他条件不变,使用催化剂,正反应速率将加快,逆反应速率将加快,平衡不移动,转化率不变;
(3)恒温恒容条件下,达到平衡后浓度不变说明是相同的化学平衡,反应是体积改变的反应,把物质都换算成方程式一边的物质,等量等效的原则进行计算判断.
解答 解;(1)反应前后是气体体积减少的反应,缩小体积相当于增大压强,平衡向气体体积减少的方向移动,所以平衡正向进行;
故答案为:正向;
(2)其他条件不变,使用催化剂,正反应速率将加快,逆反应速率将加快,平衡不移动,转化率不变,故答案为:加快;加快;不变;
(3)A.4molA+2molB 是原来初始量的2倍,相当于增大压强,平衡正向进行,C的浓度增大,故A不符合;
B、2molC+1molD,换算成AB为,2molA,1molB,与初始量相同,达到相同的平衡,C的浓度不变,故B符合;
C、2molA+1molB+2molC+1molD 转化成AB为,4molA+2molB 是原来初始量的2倍,相当于增大压强,平衡正向进行,C的浓度增大,故C不符合;
D、1molA+0.5molB+1molC+0.2molD转化成AB为,2molA,1molB,固体对平衡无影响,平衡时C为0.8mol,实际转化C为0.2mol,所以D初始量最少为0.1mol即可满足,故D符合;
故答案为:BD.
点评 本题考查的是等效平衡及化学平衡的有关计算,采用极限反应法求出C的物质的量,然后根据消耗C的物质的量确定D的最少用量,采用极限反应法是解题的关键.注意D是固体.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
12. 某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂.请填写下列空白:
某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂.请填写下列空白:
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色的变化,判断到达滴定终点的依据是:溶液由红色变为无色,半分钟内不变色.
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是D
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则起始读数为0.00mL,终点读数为26.10mL;所用盐酸溶液的体积为26.10mL.
(4)某学生根据3次实验分别记录有关数据如表:
依据上表数据计算该NaOH溶液的物质的量浓度是0.1044 mol/L.(结果保留小数点后4位)
 某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂.请填写下列空白:
某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂.请填写下列空白:(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色的变化,判断到达滴定终点的依据是:溶液由红色变为无色,半分钟内不变色.
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是D
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则起始读数为0.00mL,终点读数为26.10mL;所用盐酸溶液的体积为26.10mL.
(4)某学生根据3次实验分别记录有关数据如表:
| 滴定 次数 | 待测NaOH溶液的体积/mL | 0.100 0mol/L盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
10.一定条件下,NO2与SO2反应生成SO3和NO两种气体.将体积比为1:2的NO2、SO2气体置于密闭容器中发生上述反应,下列不能说明反应达到平衡状态的是( )
| A. | 混合气体颜色保持不变 | |
| B. | 体系的平均相对分子质量保持不变 | |
| C. | NO2和SO2的体积比保持不变 | |
| D. | 每消耗1 mol SO2的同时生成1 mol NO2 |
17. 一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g)?FeO(s)+CO(g)△H>0,1 100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2和CO的浓度与时间的关系如图所示.
一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g)?FeO(s)+CO(g)△H>0,1 100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2和CO的浓度与时间的关系如图所示.
(1)该反应的平衡常数表达式K=$\frac{c(CO)}{c(C{O}_{2})}$.
(2)下列措施中能使平衡常数K增大的是a(填序号)
A.升高温度 B.增大压强 C.充入一定量CO D.降低温度
(3)8min内,CO的平均反应速率v(CO)=0.0625mol•L-1•min-1.
(4)1 100℃时,2L的密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
①下列说法正确的是BC.
A.2c1=3c2 B.φ1=φ2 C.p1<p2 D.α1=α2
②求c1=0.67mol•L-1、φ1=33.3%、α2=55.5%.
 一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g)?FeO(s)+CO(g)△H>0,1 100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2和CO的浓度与时间的关系如图所示.
一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g)?FeO(s)+CO(g)△H>0,1 100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2和CO的浓度与时间的关系如图所示.(1)该反应的平衡常数表达式K=$\frac{c(CO)}{c(C{O}_{2})}$.
(2)下列措施中能使平衡常数K增大的是a(填序号)
A.升高温度 B.增大压强 C.充入一定量CO D.降低温度
(3)8min内,CO的平均反应速率v(CO)=0.0625mol•L-1•min-1.
(4)1 100℃时,2L的密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 | 甲 | 乙 |
| 反应物投入量 | 3mol Fe、2mol CO2 | 4mol FeO、3mol CO |
| CO的浓度(mol•L-1) | c1 | c2 |
| CO2的体积分数 | φ1 | φ2 |
| 体系压强(Pa) | p1 | p2 |
| 气态反应物的转化率 | α1 | α2 |
A.2c1=3c2 B.φ1=φ2 C.p1<p2 D.α1=α2
②求c1=0.67mol•L-1、φ1=33.3%、α2=55.5%.
11.用已知浓度的NaOH溶液滴定待测浓度的盐酸(盐酸置于锥形瓶中),以下操作会造成所测盐酸溶液浓度偏低的是( )
| A. | 酸式滴定管未用待装溶液润洗 | |
| B. | 碱式滴定管未用待装溶液润洗 | |
| C. | 滴定达终点时,仰视滴定管内液体的凹面的最低点 | |
| D. | 在滴定前碱式滴定管尖嘴部分有气泡,滴定后气泡消失 |
12.洗涤做过银镜反应的试管时,所用的试剂是( )
| A. | 氨水 | B. | NaOH溶液 | C. | 硝酸 | D. | 酒精 |
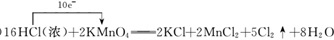 .
.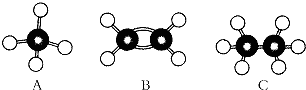
 、
、 .
.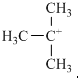 ,它是有机反应中重要的中间体,
,它是有机反应中重要的中间体,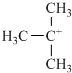 失去一个H+后将生成B的同系物F,F的结构简式为
失去一个H+后将生成B的同系物F,F的结构简式为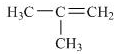 .
.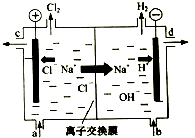 氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过.
氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过.