题目内容
把250ml含有BaCl2和AlCl3的混合溶液分成5等份,取一份加入含a mol Na2SO4的溶液,恰好使钡离子完全沉淀;另取一份加入含b mol AgNO3的溶液,恰好使氯离子完全沉淀,则该混合溶液中铝离子浓度约为( )
A、
| ||
B、
| ||
C、
| ||
| D、4(b-2a)mol/L |
考点:有关混合物反应的计算,化学方程式的有关计算
专题:计算题
分析:混合溶液分成两等份,每份溶液浓度相同.一份加入含b mol AgNO3的溶液,恰好使Cl-完全沉淀为AgCl,根据氯元素、Ag元素守恒,该份中n(Cl-)=n(AgCl)=n(AgNO3);另一份加入含amol Na2SO4的溶液,恰好使硫酸根离子完全沉淀为BaSO4,根据钡离子与硫酸根守恒可知该份中n(Ba2+)=n(BaSO4)=n(Na2SO4),再利用电荷守恒可知每份中3n(Al3+)+2n(Ba2+)=(Cl-),据此计算每份中n(Al3+),根据c=
计算Al3+的浓度.
| n |
| V |
解答:
解:混合溶液分成两等份,每份溶液浓度相同.一份加入含a mol AgNO3的溶液,恰好使Cl-完全沉淀为AgCl,根据氯元素、Ag元素守恒,该份中n(Cl-)=n(AgCl)=n(AgNO3)=amol;
另一份加入含bmol Na2SO4的溶液,恰好使硫酸根离子完全沉淀为BaSO4,根据钡离子与硫酸根守恒,可知该份中n(Ba2+)=n(BaSO4)=n(Na2SO4)=bmol;
根据电荷守恒,可知每份中3n(Al3+)+2n(Ba2+)=(Cl-),则每份中n(Al3+)=
mol,则c(Al3+)=
mol/L=
(b-2a)mol/L.
故选B.
另一份加入含bmol Na2SO4的溶液,恰好使硫酸根离子完全沉淀为BaSO4,根据钡离子与硫酸根守恒,可知该份中n(Ba2+)=n(BaSO4)=n(Na2SO4)=bmol;
根据电荷守恒,可知每份中3n(Al3+)+2n(Ba2+)=(Cl-),则每份中n(Al3+)=
| b-2a |
| 3 |
| ||
| 0.05 |
| 20 |
| 3 |
故选B.
点评:本题考查离子反应计算、混合物有关计算,难度中等,根据电荷守恒计算钾离子的物质的量是关键.

练习册系列答案
相关题目
下列现象或事实可用同一原理解释的是( )
| A、氯化钠和氯化镁溶液分别与硝酸银溶液混合都能产生白色沉淀 |
| B、浓硫酸和稀盐酸长期暴露在空气中浓度降低 |
| C、氯水和活性炭使红墨水褪色 |
| D、漂白粉和水玻璃长期暴露在空气中变质 |
下列物质既能与盐酸又能与氢氧化钠反应的是( )
①Al2O3 ②Al(OH)3 ③NaHCO3 ④Fe ⑤CaCO3 ⑥SiO2.
①Al2O3 ②Al(OH)3 ③NaHCO3 ④Fe ⑤CaCO3 ⑥SiO2.
| A、①②③ | B、①②⑥ |
| C、④⑤⑥ | D、②③⑤ |
下列物质久置于敞口容器中,不易变质的是( )
| A、NaCl |
| B、Na |
| C、CaO |
| D、Ca( ClO)2 |
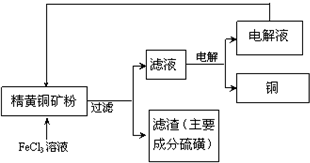 工业上以黄铜矿(主要成分CuFeS2)为原料制备金属铜,有如下两种工艺.
工业上以黄铜矿(主要成分CuFeS2)为原料制备金属铜,有如下两种工艺.


 处理含CO、SO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质S(g).发生反应为:2CO(g)+SO2(g)?S(g)+2CO2(g)
处理含CO、SO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质S(g).发生反应为:2CO(g)+SO2(g)?S(g)+2CO2(g)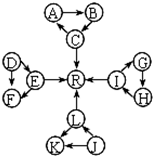 某化学兴趣小组在探究常见物质转化时,发现部分物质存在如图所示的三角转化关系(部分反应物或生成物已略去):
某化学兴趣小组在探究常见物质转化时,发现部分物质存在如图所示的三角转化关系(部分反应物或生成物已略去):