题目内容
醋酸中存在着电离平衡,请写出醋酸的电离平衡常数表达式 .室温下,体积都为1L、氢离子浓度都为0.01mol?L-1 的盐酸和醋酸分别与0.48g镁反应,反应结束时,两种酸中产生氢气较多的酸是 .
考点:弱电解质在水溶液中的电离平衡
专题:
分析:根据电离平衡常数为生成物浓度幂之积与反应物浓度幂之积的商进行书写;
由于醋酸是弱酸,所以氢离子浓度都为0.01mol?L-1 的盐酸和醋酸,醋酸的浓度比盐酸的浓度大的多,又0.48g镁即
=0.02mol,根据Mg+2HCl=MgCl2+H2,盐酸少量,又醋酸比盐酸多得多来分析.
由于醋酸是弱酸,所以氢离子浓度都为0.01mol?L-1 的盐酸和醋酸,醋酸的浓度比盐酸的浓度大的多,又0.48g镁即
| 0.48 |
| 24 |
解答:
解:电离平衡常数为生成物浓度幂之积与反应物浓度幂之积的商,即K=
;
由于醋酸是弱酸,所以氢离子浓度都为0.01mol?L-1 的盐酸和醋酸,醋酸的浓度比盐酸的浓度大的多,又0.48g镁即
=0.02mol,根据Mg+2HCl=MgCl2+H2,盐酸少量,又醋酸比盐酸多得多,所以产生氢气较多的酸是醋酸,
故答案为:K=
;醋酸.
| c(CH 3COO -)?c(H +) |
| c(CH 3COOH) |
由于醋酸是弱酸,所以氢离子浓度都为0.01mol?L-1 的盐酸和醋酸,醋酸的浓度比盐酸的浓度大的多,又0.48g镁即
| 0.48 |
| 24 |
故答案为:K=
| c(CH 3COO -)?c(H +) |
| c(CH 3COOH) |
点评:本题考查电离平衡常数的表达式以及弱电解质的电离,注意氢离子浓度相等的强酸和弱酸,弱酸的浓度要比强酸大得多,为易错点.

练习册系列答案
相关题目
氯仿(CHCl3)可作全身麻醉剂,但在光照下易被氧化生成光气(COCl2):2CHCl3+O2
2COCl2+2HCl.COCl2易爆炸,为防止事故,使用前应先检验是否变质,你认为检验用的最佳试剂是( )
| 光 |
| A、烧碱溶液 |
| B、溴水 |
| C、AgNO3溶液 |
| D、淀粉KI试剂 |
在含有Ba2+、Ca2+、Ag+的酸性溶液中,可能存在的阴离子是( )
| A、SO42- |
| B、NO3- |
| C、Cl- |
| D、CO32- |
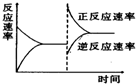 如图是关于反应A2(g)+3B2(g)=2C(g)(正反应为放热反应)的平衡移动图形,影响平衡移动的原因是( )
如图是关于反应A2(g)+3B2(g)=2C(g)(正反应为放热反应)的平衡移动图形,影响平衡移动的原因是( )| A、升高温度,同时加压 |
| B、降低温度,同时减压 |
| C、增大反应物浓度,同时使用催化剂 |
| D、增大反应物浓度,同时减小生成物浓度 |
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法错误的是( )

| A、该硫酸具有强烈的腐蚀性,应放于危险化学用品柜中妥善保管 |
| B、取10 mL该硫酸于烧杯中,再加入10mL的水,可配得49%的硫酸 |
| C、配制200mL4.6mol/L的稀硫酸需取该硫酸50 mL |
| D、该硫酸与等质量的水混合所得溶液的物质的量浓度小于9.2mol/L |