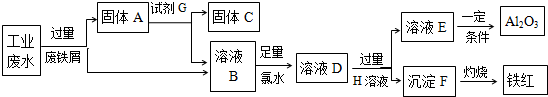
题目内容
5.10.7g氯化铵与足量氢氧化钙混合共热,最多可制得:①NH3的物质的量是多少?
②将制得的氨气全部溶于水制成2L溶液,所得氨水物质的量浓度为多少?
分析 根据n=$\frac{m}{M}$计算10.7g氯化铵的物质的量,反应的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,根据方程式计算生成的氨气的物质的量,进而计算氨水物质的量浓度
解答 解:①10.7g氯化铵的物质的量为:n=$\frac{m}{M}$=$\frac{10.7g}{53.5g/mol}$=0.2mol,根据方程式计算:
2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O
2mol 2mol
0.2mol n
n=$\frac{2mol×0.2mol}{2mol}$=0.2mol,故答案为:①NH3的物质的量是0.2mol;
②将制得的氨气全部溶于水制成2L溶液,所得氨水物质的量浓度为:c=$\frac{n}{V}$=$\frac{0.2mol}{2L}$=0.1mol/L,
故答案为:②所得氨水物质的量浓度为0.1mol/L.
点评 本题考查物质的量应用于化学方程式的计算,题目难度不大,注意化学方程式的书写以及物质的量的有关计算公式的运用.

练习册系列答案
相关题目
16.铯137是金属铯的同位素之一,与“铀235”同属于放射性物质.下列对${\;}_{55}^{137}$Cs与${\;}_{92}^{235}$U描述正确的是( )
| A. | Cs与U的质子数差值为37 | B. | Cs与U的中子数差值为98 | ||
| C. | 铯137的电子数是82 | D. | 铀元素的相对原子质量是235 |
13.有机化学中取代反应范畴很广,下列4个反应中,属于取代反应范畴的是( )
| A. | 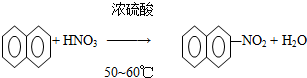 | |
| B. | 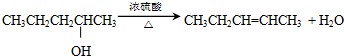 | |
| C. | CH3CHO+H2$→_{催化剂}^{高温高压}$CH3CH2OH | |
| D. | (CH3)2CHCH=CH2+HI→(CH3)2CHCHICH3+(CH3)2CHCH2CH2 I |
10.下列物质的电子式书写正确的是( )
| A. |  | B. |  | C. | Cl:Cl | D. | Na+[F]- |
14.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,22.4 L二氯甲烷的分子数约为NA个 | |
| B. | 盛有SO2的密闭容器中含有NA个氧原子,则SO2的物质的量为0.5 mol | |
| C. | 17.6g丙烷中所含的极性共价键为4NA个 | |
| D. | 1molFeI2与足量氯气反应时转移的电子数为2NA |
15.下列除去少量杂质的方法正确的是( )
| A. | Zn粉中含少量的ZnO:加入足量稀H2SO4充分反应后过滤 | |
| B. | Cu(NO3)2溶液中含少量AgNO3:加入足量Cu屑充分反应后过滤 | |
| C. | Na2SO4溶液中含少量H2SO4:加入足量Ba(OH)2充分反应后过滤 | |
| D. | CaCO3固体中含少量Na2CO3:加入足量稀HCl充分反应后过滤 |