题目内容
7.下列离子方程式中书写正确的是( )| A. | 固体氯化铵和消石灰混合并加热 NH4++OH-═MH3↑+H20 | |
| B. | 氨水通人过量的二氧化碳 NH3•H20+CO2═NH4++HCO3- | |
| C. | 磷酸二氢钙溶液中加入过量的氢氧化钙 2H2PO4-+3Ca2++40H-═Ca3(PO4)2↓+4H2O | |
| D. | 硫化亚铁与盐酸反应 S2-+2H+═H2S↑ |
分析 A.固体氯化铵、氢氧化钙都不能拆;
B.二氧化碳过量反应生成碳酸氢铵;
C.氢氧化钙过量反应生成硫酸钙和水;
D.硫化亚铁为沉淀,应保留化学式.
解答 解:A.固体氯化铵和消石灰混合并加热,离子方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑,故A错误;
B.氨水通人过量的二氧化碳,离子方程式:NH3•H20+CO2═NH4++HCO3-,故B正确;
C.磷酸二氢钙溶液中加入过量的氢氧化钙,离子方程式:2H2PO4-+3Ca2++40H-═Ca3(PO4)2↓+4H2O,故C正确;
D.硫化亚铁与盐酸反应,离子方程式:FeS+2H+═H2S↑+Fe2+,故D错误;
故选:BC.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意氯化铵与氢氧化钙反应中固体状态下发生反应所以不能写成离子形式,题目难度中等.

练习册系列答案
 导学教程高中新课标系列答案
导学教程高中新课标系列答案
相关题目
7.下列变化不可能通过一步反应直接完成的是( )
| A. | Al2O3→Al(OH)3 | B. | Na→Na2O2 | C. | Fe(OH)2→Fe(OH)3 | D. | Al(OH)3→AlO2- |
18.用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g)?CH3OH(g)△H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示.下列说法正确的是( )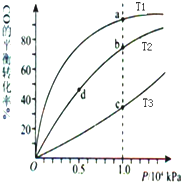

| A. | 温度:T1>T2>T3 | B. | 平衡常数:K(a)>K(c) K(b)=K(d) | ||
| C. | 正反应速率:v(a)>v(c) v(b)>v(d) | D. | 平均摩尔质量:M(a)<M(c) M(b)>M(d) |
15.将X、Y、Z三块大小相同的金属片分别投入到10%的稀盐酸中,X表面无明显现象,Y表面缓慢地产生气泡,Z表面迅速产生大量气泡.则X、Y、Z的金属活动性顺序为( )
| A. | X>Z>Y | B. | Z>Y>X | C. | X>Y>Z | D. | Z>X>Y |
2.配制溶质质量分数一定的氯化钠溶液涉及的操作有:①称量 ②溶解 ③计算,其正确的操作顺序为( )
| A. | ②①③ | B. | ②③① | C. | ③①② | D. | ③②① |
19.下来有关物质分离方法的叙述中,不正确的是( )
| A. | 用过滤的方法分离溶液和胶体 | |
| B. | 用四氯化碳萃取碘水中的碘 | |
| C. | 用蒸馏的方法将自来水制成蒸馏水 | |
| D. | 用加热的方法分离氯化钠和单质碘固体 |
16.锌与100mL 18.5mol•L-1的浓硫酸充分反应后,锌完全溶解,同时生成气体甲33.6L(标准状况).将反应后的溶液稀释至1L,测得溶液中c(H+)=0.1mol/L.下列叙述正确的是( )
| A. | 反应中共消耗1.75 mol H2SO4 | B. | 气体甲中SO2与H2的体积比为1:4 | ||
| C. | 反应中共消耗65 g Zn | D. | 反应中共转移3.6 mol电子 |
17.下列关于有机化合物的说法正确的是( )
| A. | 可用纤维素的水解产物制取乙醇 | |
| B. | 己烷(C6H14)有四种同分异构体 | |
| C. | 乙烯、聚氯乙烯和苯分子中均含有碳碳双键 | |
| D. | 糖类、油脂和蛋白质均可发生水解反应 |

 .
.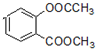 +3NaOH→CH3COONa+CH3OH+
+3NaOH→CH3COONa+CH3OH+ +H2O.
+H2O.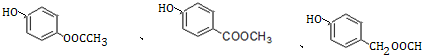 .
.